Cell 重磅!全球首位女性艾滋病患者或已被治愈,艾滋病治愈或许迎来新机遇
来源:iNature 2023-03-17 11:20
此前,有两名男性通过CCR5Δ32纯合(CCR5Δ32/Δ32)异体成体干细胞移植治愈了HIV-1。
此前,有两名男性通过CCR5Δ32纯合(CCR5Δ32/Δ32)异体成体干细胞移植治愈了HIV-1。
2023年3月16日,威尔康奈尔医学院许静美(音译,Hsu Jingmei)团队在Cell 在线发表题为“HIV-1 remission and possible cure in a woman after haplo-cord blood transplant”的研究论文,该研究报告了一名接受CCR5Δ32/Δ32单倍相合脐带血移植(脐带血细胞与来自成人的单倍相合干细胞结合)治疗急性髓系白血病(AML)的混血女性的第一例缓解和可能的HIV-1治愈。
移植后第14周,脐带血嵌合率为100% CCR5Δ32/Δ32,并持续随访4.8年。免疫重建与以下因素相关:(1)丧失可检测复制能力的HIV-1储存库,(2)丧失HIV-1特异性免疫反应,(3)体外对X4和R5实验室变体的耐药性,包括移植前的自体潜伏储存库分离物,以及(4)移植后37个月开始停用抗逆转录病毒治疗,伴病毒血症18个月的HIV-1控制。总之,CCR5Δ32/Δ32单倍相合移植实现了缓解和可能的HIV-1治愈。
另外,2023年2月20日,德国海因里希·海涅大学Björn-Erik Ole Jensen等人在Nature Medicine在线发表题为”In-depth virological and immunological characterization of HIV-1 cure after CCR5Δ32/Δ32 allogeneic hematopoietic stem cell transplantation“的研究论文,该研究描述了一例长期HIV-1缓解的53岁男性患者,他在进行了异基因CCR5Δ32/Δ32 HSCT治疗急性髓系白血病后被监测了9年以上。尽管在外周血T细胞亚群和组织来源样本中(通过液滴数字PCR和原位杂交)检测到零星的HIV-1 DNA痕迹,但在人化小鼠中(重复的体外定量和体内生长试验)没有发现复制能力病毒。低水平的免疫激活和减弱的HIV-1特异性体液和细胞免疫反应表明缺乏持续的抗原生产。在分析治疗(CCR5Δ32/Δ32 HSCT)中断四年后,病毒反弹的缺失和HIV-1抗原持久性的免疫相关性缺乏是HIV-1治愈的强有力证据。
全世界有近3800万人携带HIV-1病毒,其中美国估计有120万人。HIV-1感染是无法治愈的,因为HIV-1潜伏在长寿命的静息记忆CD4+ T细胞中。当抗逆转录病毒治疗(ART)停止时,这些潜伏的前病毒会加剧病毒血症,需要终身治疗。CCR5是一种β趋化因子受体基因,是HIV-1感染CD4+ T细胞的主要共受体。
纯合子CCR5Δ32移码突变删除了编码区32个碱基对(CCR5Δ32/Δ32),消除了CCR5的细胞表面表达。这种变化赋予了对CCR5-tropic HIV-1变异的天然抗性。大约10%的北欧白人携带CCR5基因Δ32突变;然而,只有1%的突变是纯合的。移植CCR5Δ32/Δ32干细胞可以根除HIV-1储存库,将免疫系统替换为对HIV-1有抗性的免疫系统,最终使因潜在疾病需要移植的PLWH得到HIV-1缓解和治愈。先前报告了两例已发表的HIV-1治愈病例,使用不相关的成人CCR5Δ32/Δ32干细胞捐赠者。
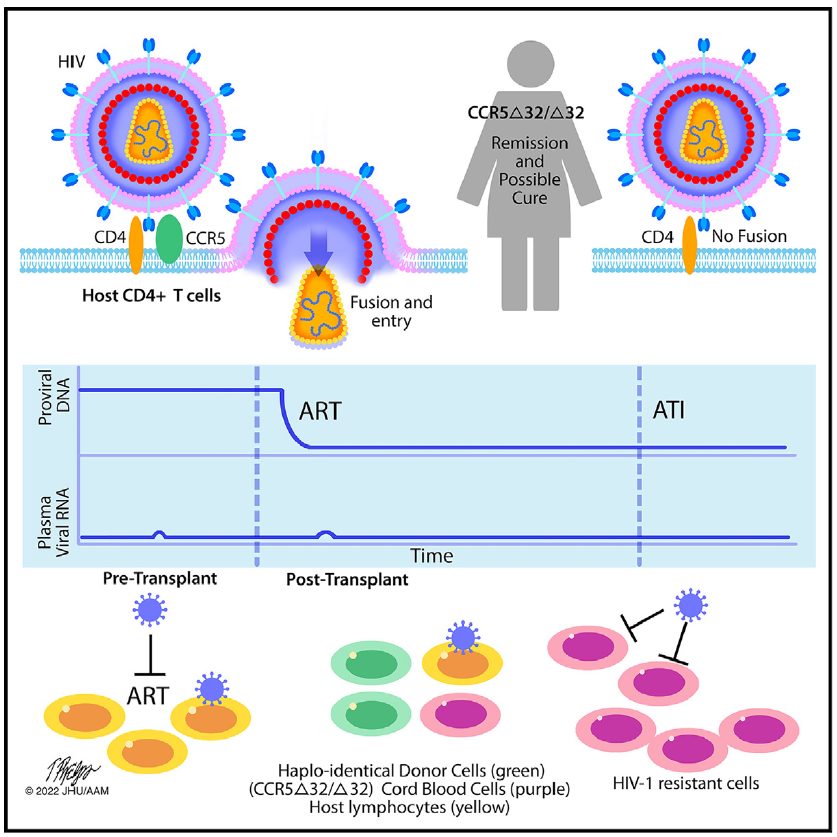
文章模式图(图源自Cell )
伦敦病人:Adam Castillejo,接受了HLA匹配CCR5Δ32/Δ32成人非亲缘捐赠者干细胞移植治疗他的霍奇金淋巴瘤。据报道,他在接受抗逆转录病毒治疗18个月后病情缓解,30个月后痊愈,没有出现HIV-1病毒血症反弹。
此外,Duesseldorf患者是一名HIV-1感染者,他也因急性髓性白血病接受了成人CCR5Δ32/Δ32干细胞移植,在抗逆转录病毒治疗中断(ATI)后出现了6个月的病毒血症。在撰写本报告时,没有最新的出版信息可以确定更长的缓解时间或HIV-1治愈时间。
使用CCR5Δ32/Δ32的干细胞移植是罕见的,因为CCR5Δ32/Δ32在人群中的患病率极低,而且很少有登记对成人干细胞捐赠者进行这种突变的筛查。然而,脐带血(CB)可能是种族多样化的PLWH更好的供体干细胞。即使移植物只与HLA部分匹配,且移植物抗宿主病较少,CB也能成功移植。在国际孕产妇儿科青少年艾滋病临床试验 (IMPAACT) P1107研究(NCT02140944)中,研究人员假设获得预先筛选的CCR5Δ32/Δ32基因突变脐带血单位(CBUs)将扩大非白人HIV-1感染者的供体细胞池。
该研究报告了一名中年混血女性,她在被诊断为急性HIV-1感染并接受抗逆转录病毒治疗4年后患上AML,缓解和可能的HIV-1治愈。她被移植了来自StemCyte国际脐带血中心注册中心(StemCyte)的CCR5Δ32/Δ32纯合子CBU,结合CD34选择的来自具有野生型CCR5等位基因的单倍相合亲缘供体的干细胞。
参与者的移植导致CCR5Δ32/Δ32 CB细胞快速植入和免疫替代,AML缓解。在移植前,HIV-1复制被抑制到临床无法检测到的水平,即使在ART中断后也能保持。相关的病毒、免疫和潜伏的HIV-1库研究与外周血中HIV-1的消除一致,这在移植前是可检测到的。移植后55个月,她仍然没有癌症,停用抗逆转录病毒疗法18个月后也没有病毒反弹,这表明她的病情有所缓解,可能治愈HIV-1。在停用抗逆转录病毒治疗后,没有检测到循环复制能力强的前病毒库。抗逆转录病毒(ARVs)在ART中断前的多个时间点在血浆中检测到,但在ART中断后没有检测到,证实了无ART的HIV-1缓解和可能治愈。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


