量子计算赋能AI模型,英矽智能设计出“不可成药”靶点KRAS的新型抑制剂
来源:生物世界 2025-01-26 10:14
科学家将量子计算模型与经典计算模型和生成式人工智能相结合,通过对庞大数据集的训练、生成和筛选,探索更广泛的化学可能性,发现了靶向“不可成药”的癌症驱动蛋白 KRAS 的新颖分子。
近期,英矽智能(Insilico Medicine)与多伦多大学共同主导的一项研究,首次展示量子计算和人工智能在变革药物发现流程方面的潜力。
在这项研究中,科学家将量子计算模型与经典计算模型和生成式人工智能相结合,通过对庞大数据集的训练、生成和筛选,探索更广泛的化学可能性,发现了靶向“不可成药”的癌症驱动蛋白 KRAS 的新颖分子。
相关研究成果于 2025 年 1 月 22 日发表在了 Nature Biotechnology 期刊,论文题为:Quantum-computing-enhanced algorithm unveils potential KRAS inhibitors。

KRAS 突变是癌症中常见的突变之一,出现在大约四分之一的人类肿瘤中。KRAS 突变会导致细胞不受控制的增殖进而引发癌症。尽管 KRAS 突变非常普遍且影响巨大,但目前只有两种专门针对突变 KRAS 的药物获得了美国 FDA 的批准。而且,临床数据显示,与传统化疗相比,这些药物仅能延长患者几个月的生命。
因此,改良 KRAS 靶向疗法,使它为癌症患者带来更多的获益,成为当前尚未被满足的迫切需求。
在这项研究中,为了生成潜在新型 KRAS 抑制剂,研究团队提出了一种由量子变分生成模型(QCBM)和长短期记忆网络(LSTM)相结合的量子-经典混合框架模型,将量子计算与经典计算方法结合起来设计新分子。他们首先利用一个包含 110 万种分子的定制数据集对混合模型进行训练,其中包括 650 种从文献中获得的先前经实验验证可阻断 KRAS 的分子,使用 STONED-SELFIES 算法参考现有 KRAS 抑制剂生成 850000 种类似物、以及通过开源超大型虚拟筛选平台 VirtualFlow 获得的 25 万种分子数据,这些训练帮助优化了综合模型。
接下来,研究团队利用混合模型生成了 100 万种候选分子。在这个过程中, 量子变分生成模型(QCBM)作为量子生成模型,利用量子电路来学习复杂的概率分布,从而生成与训练数据相似的新样本。此外,它还在整个过程中充当先验,指导长短期记忆网络(LSTM)生成新的配体样本。LSTM 作为经典模型,处理化学结构的序列数据,并在此基础上生成新的分子序列。这种结合使得生成的分子既能从量子模型中获得复杂的概率分布,又能通过经典模型进行序列化处理,从而提高生成分子的质量和多样性。
研究团队进一步使用英矽智能的生成式人工智能引擎 Chemistry42 对分子进行过滤,其中包括类药性筛选、分子对接排序和合成可及性等多维度评估指标,并从中确定了 15 种最有希望进行实验室测试的候选分子。经过湿试验测试,在这 15 种候选分子中,有 2 种分子脱颖而出,具有新颖的结构且没有显著细胞毒性。
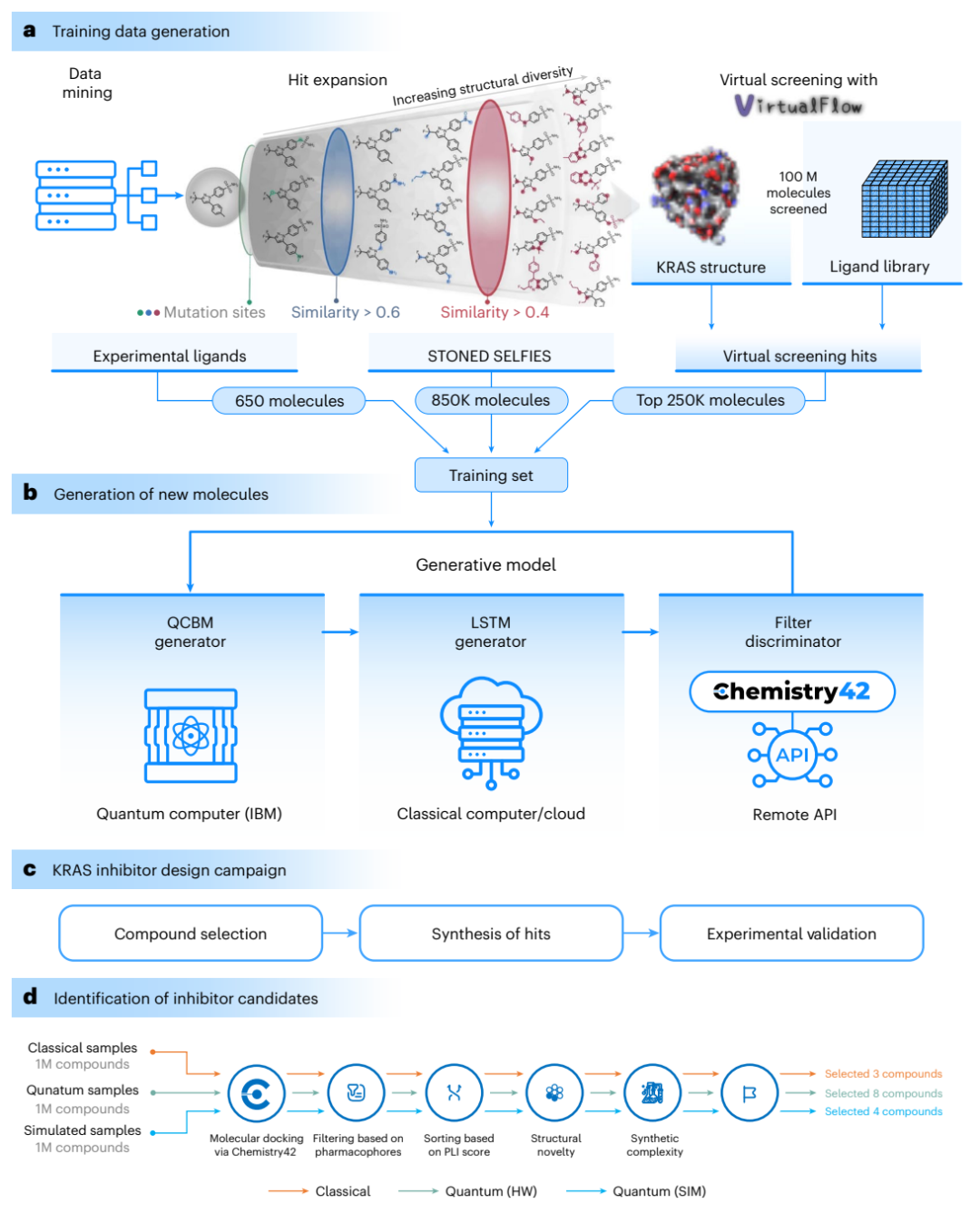
混合模型训练和分子生成过程
其中,ISM061-018-2 表现出了优于其他分子的与靶蛋白结合的效力,同时该分子即使在高浓度下也未表现出显著的非特异性细胞毒性。除了野生型 KRAS 以外,ISM061-018-2 同时对另外五种常见突变型 KRAS 以及野生型 HRAS、NRAS 展示出了剂量依赖的抑制活性,这一结果展示了其作为具有全新结构的泛 RAS 抑制剂的潜力。论文中还展示了另一个具有泛 Ras 抑制剂潜力的化合物——ISM061-022,该化合物相对于 ISM061-018-2,展示出对特定突变型KRAS(G12R和Q61H)增强的抑制活性。
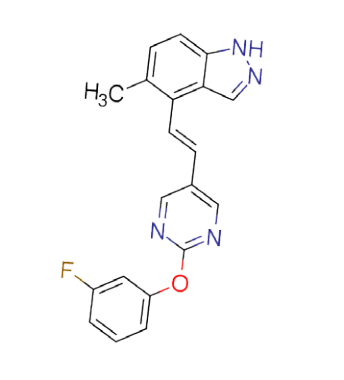
ISM061-018-2
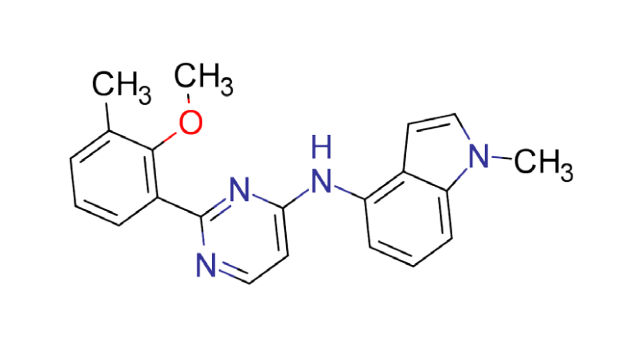
ISM061-022
传统的药物发现方法依赖于对现有化合物库进行筛选,以找到对特定靶蛋白有活性的化合物。这些方法成本高、耗时长,而且化合物的管理也有繁杂的流程。利用创新的方法,大部分筛选工作都能在云端完成,无需物理空间来存储化学库,也不需要机器人来进行大型筛选。
值得注意的是,虽然这些成果证明了量子计算在加速药物发现早期阶段的潜力,但它们并没有证明用这种方法发现的分子比用经典方法发现的分子更有效。
项目负责人、加拿大多伦多大学化学与计算机科学教授 Alán Aspuru-Guzik 博士表示,在药物化学、量子计算和人工智能的跨学科融合领域处工作令人倍感兴奋。这项具有首创性的研究表明,量子计算机可以被纳入现代人工智能驱动的药物发现流程,并成功地找到与生物靶标相互作用的分子。这是一项原理验证研究,但并没有提供任何量子优势显著的迹象。随着量子计算机功能的增强,我们的算法有望表现得越来越好。
在对 KRAS 成功研究的基础上,研究团队正在将他们的量子-经典混合模型应用于其他“不可成药”的蛋白,与 KRAS 类似这些蛋白质通常很小,表面缺乏轮廓,使分子难以与之结合。研究团队还计划利用混合模型进一步对两款 KRAS 的苗头化合物展开进一步的优化设计,旨在动物模型中进一步验证具有前景的新型 KRAS 抑制剂。
论文共同通讯作者、英矽智能创始人兼首席执行官 Alex Zhavoronkov 博士表示,多达 85% 的人类蛋白质被认为是“不可成药”的,这是开发癌症新疗法所面临的一大挑战,而人工智能在这方面具有得天独厚的优势。多伦多大学和英矽智能之间的合作是一个很好的例子,展示了初创公司和科研院所如何利用各自的专场推动技术进步,更好的为实现人类的长久健康共同努力。
此前,英矽智能就曾与多伦多大学合作,探索将量子计算机融入现代人工智能驱动的研发流程,以加速临床前药物发现。2023 年,由双方科学家组成的研究团队在计算化学领域权威期刊、美国化学学会旗下 Journal of Chemical Information and Modeling 期刊上发表了第一篇合作论文,通过三个实验,逐步以变分量子线路(VQC)取代 MolGAN(一种用于小分子图的隐式生成式模型)的各个部分,包括作为噪声生成器、切片法下的生成器和判别器,并将混合模型产生的结果与经典 GAN 模型输出的结果相对比,探索量子生成式对抗网络在小分子药物发现中的潜在优势。

相关阅读:
2024年12月11日,英矽智能(Insilico Medicine)的研究人员在 Nature Biotechnology 期刊发表了题为:Intestinal mucosal barrier repair and immune regulation with an AI-developed gut-restricted PHD inhibitor 的研究论文。
该研究描述了英矽智能的生成式人工智能药物设计平台 Chemstry42 及其下属模块设计的一款肠道限制性的 PHD 特异性抑制剂,用于治疗炎症性肠病(IBD),并在临床前显示出了对肠黏膜屏障的修复和免疫调节作用。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


