《细胞》揭秘tau蛋白作用机制
来源:本站原创 2022-02-08 10:49
微管相关蛋白Tau(MAPT)基因的突变足以引起家族性额颞叶痴呆(FTD),并且,Tau还是导致阿尔茨海默病(AD)、皮质基综合征和进行性核上性麻痹(PSP)综合征等其他tau蛋白病神经退行性疾病的主要因素。
微管相关蛋白Tau(MAPT)基因的突变足以引起家族性额颞叶痴呆(FTD),并且,Tau还是导致阿尔茨海默病(AD)、皮质基综合征和进行性核上性麻痹(PSP)综合征等其他tau蛋白病神经退行性疾病的主要因素。近日,美国格拉斯顿学院研究者在cell杂志上发表了题为“Tau interactome maps synaptic and mitochondrial processes associated
with neurodegeneration”的文章,该研究揭示了Tau在神经元功能和疾病中的作用,并突出了阻断Tau介导的发病机制的潜在治疗靶点。
图片来源:
https://doi.org/10.1016/j.cell.2021.12.041
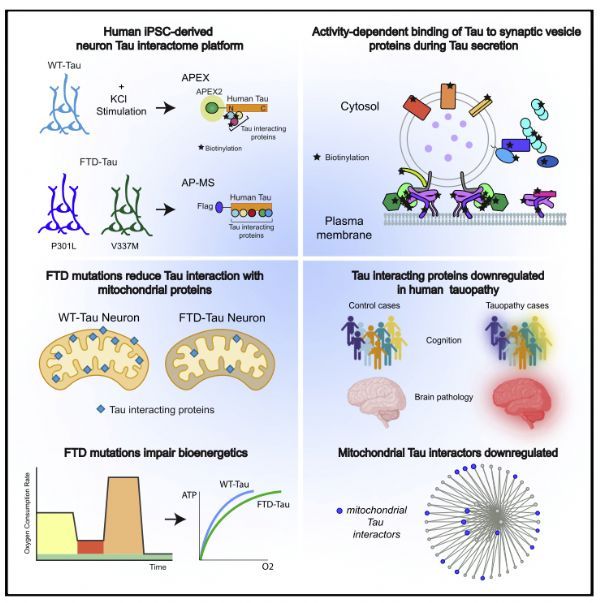
为了研究人类神经元中Tau相互作用体的特征,作者利用工程抗坏血酸过氧化物酶(APEX)邻位依赖的质谱和AP-MS映射,揭示了人类诱导多能干细胞(ipsC)衍生的谷氨酸神经元中Tau的动态和多面相互作用体。在这里,APEX映射使作者能够阐明在增强的神经元活动中Tau相互作用体的空间调节。AP-MS可以定量比较人类神经元中野生型Tau和FTD突变型Tau的蛋白-蛋白相互作用。
作者的APEX图谱显示了与Tau的N-末端结构域和C-末端结构域的明显相互作用,这可能部分是由Tau片段或通过结构域特异性的相互作用介导的。据估计,APEX2生物素化蛋白质的距离可达10-20 nm,而Tau蛋白的长度约为63-70
nm,从而允许N或C末端附近相互作用的空间分辨率。在Tau的N或C末端的APEX标签的存在也可能阻止蛋白质与Tau结合,导致明显的结构域特异性相互作用。
作者发现神经元活动增强了Tau与SNARE和突触囊泡蛋白的相互作用,提示突触前囊泡融合机制可能通过直接的蛋白质-蛋白质相互作用来调节活性依赖性Tau的释放。突触前终末的去极化导致结合SYT1的局部钙内流,SYT1与SNARE复合体中的Synaxin1/SNAP25相互作用,迫使质膜破裂以进行囊泡融合。
破伤风毒素可抑制神经元活性诱导的Tau释放,破坏SNARE复合体的功能,支持SNARE复合体在Tau释放中的关键作用。另一种已提出的Tau释放机制涉及Exosome介导的Tau释放和跨突触连接的摄取。在人类神经元培养中,大部分分泌的Tau是自由漂浮的,在细胞外小泡中检测到少量的Tau,这表明细胞培养中Tau的释放可能有多种机制。
另外,作者还发现,尽管TauV337M和TauP301L减弱了与某些核糖体蛋白的相互作用,但人类神经元中的Tau与RNA结合蛋白存在相互作用。事实上,其他研究表明,突变的Tau减少了与核糖体的相互作用,导致不同FTD小鼠模型的蛋白质合成减少,包括核糖体亚单位。
Tau相互作用体绘制与神经退行性变相关的突触和线粒体过程
图片来源:
https://doi.org/10.1016/j.cell.2021.12.041
尽管致病性Tau有广泛的生理后果,但由于缺乏对Tau如何直接介导这些过程的了解,Tau靶向治疗的发展一直受到限制。作者的工作为Tau通过人类神经元中的蛋白质-蛋白质相互作用直接影响细胞功能的可能机制提供了广泛的资源,这为有效的tau靶向策略对抗神经退变过程铺平了道路。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。