Cell | 南方科技大学张明杰团队揭示细胞内短距离囊泡运输的新机制:相分离在神经传递中的角色
来源:生物探索 2024-04-06 11:14
该研究发现Pclo响应Ca2+并通过与SVs相分离,可以从突触蛋白聚集的凝聚物中提取SVs。
南方科技大学张明杰团队在Cell 在线发表题为“Short-distance vesicle transport via phase separation”的研究论文,该研究以突触囊泡(SV)运输为范例,证明了突触蛋白与囊泡的相分离可以促进不同突触前亚室之间受调节的定向囊泡运输。
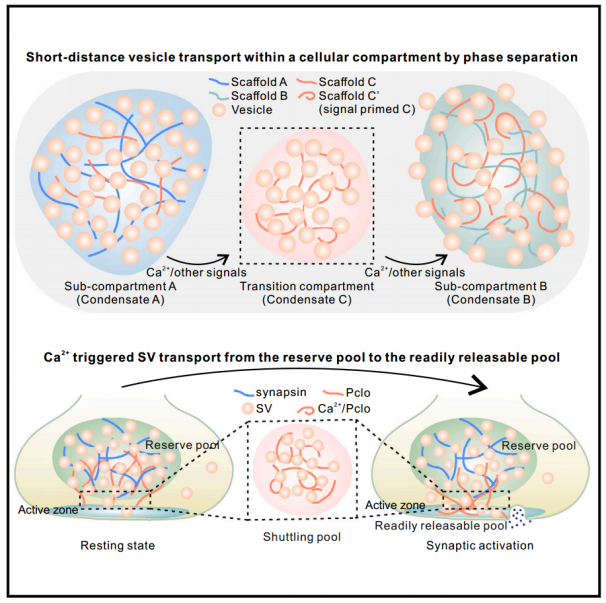
具体来说,一个大线圈支架蛋白Piccolo响应Ca2+,通过其C2A结构域介导的Ca2+感应,可以从突触蛋白聚集的储备池冷凝水中提取SVs,并将提取的SVs沉积在活性区蛋白质冷凝水的表面。进一步表明,Trk融合基因TFG也通过相分离参与COPII囊泡从内质网转运到内质网-高尔基体中间区。因此,相分离可能在细胞内的短距离定向囊泡运输中起普遍作用。

从本质上讲,所有的囊泡运输过程都涉及膜囊的定向运动,以所需的速度来应对不同的细胞需要。与生物分子或其复合物相比,细胞囊泡非常大且重,因此在拥挤的细胞环境中扩散极其缓慢。因此,囊泡在不同细胞间的定向长距离运动总是涉及基于细胞骨架的分子马达。
细胞囊泡也需要局部短距离运输。例如,不同的囊泡沿着平坦的高尔基池堆以几百纳米的距离快速地顺行和逆行移动。在神经细胞的轴突末端上,突触囊泡(SVs)以几百纳米的距离和精确的时间间隔从囊泡储存器到神经递质释放点再次经历快速和重复的运动。与远距离的囊泡运输不同,人们对细胞内局部定向的囊泡运动是如何实现的知之甚少。这种局部的、短距离的囊泡运输并不涉及分子马达。随机扩散不能解释局部而定向的囊泡运输,因为随机扩散缺乏方向性。因此,必须存在某些过程来积极促进局部细胞室中囊泡的短途运输。
成熟的SVs经过运动介导的长距离转运到每个轴突末端按钮后,被组织成三个亚室,对应三个不同的功能池:储备池,占SVs总数的80%以上,聚集在突触前膜-远端区;随时可释放池(RRP),占总数的5%以下,与突触前质膜正下方的活跃区相连;以及回收/穿梭池,这是一个相当虚构的SVs群体,在储备池和RRP之间穿梭。突触激活后,储备池中的SVs可以快速、反复地转运到活跃区补充释放的SVs。这种活性诱导的SV运输不涉及分子马达,因为EM研究表明,在连接质膜的活性区和SV储备池之间的200-300 nm空间中没有肌动蛋白丝或微管。
模式图(Credit: Cell)
最近的研究表明,一组突触前支架蛋白或其复合物可以通过相分离形成不同的凝聚无膜细胞器。这些突触前无膜细胞器与膜性SVs相互作用,每个都有独特的模式。例如,突触素和交叉素(ITSN)凝聚物可以通过与SVs凝聚而聚集SVs。相反,SVs覆盖在由RIM、RIMBP和elks形成的活性区凝聚物的表面。因此,这些不同的突触前蛋白凝聚物可以将SVs组织成不同的池,从而定义具有不同功能的生化相同的SVs。目前尚不清楚SVs如何从储备池运送到RRP。
Piccolo(Pclo)和Bassoon是脊椎动物特有的巨型支架蛋白(Pclo > 500 kDa;Bassoon> 400 kDa)能够将活跃区与突触蛋白凝聚物连接起来。Pclo和Bassoon的消融导致总SVs显著降低,活性区停靠和总回收池SVs均受损。相反,敲除突触素只损害储备池而不损害对接的SVs。敲除RIM、RIMBP和ELKS仅影响RRP SVs,而不改变储备池SVs。Pclo和/或Bassoon基因操作对多个SVs库的同时影响提示,这两种支架蛋白可能协调突触前按钮中不同SVs库之间的通信。
该研究发现Pclo响应Ca2+并通过与SVs相分离,可以从突触蛋白聚集的凝聚物中提取SVs。值得注意的是,Pclo可以将提取的SVs以Ca2+依赖的方式输送到活性区凝析液表面。因此,Pclo可以通过Ca2+调控的突触前支架蛋白相分离,促进SVs从储备池转运到活性区。该研究还提供证据表明,细胞中分泌囊泡的短途运输也受到蛋白质相分离的调节。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


