Trends Neurosci+Free Radic Biol Med:刘丹倩团队发表两篇睡眠调控机制的综述
来源:brainnews 2025-12-04 16:12
两项工作共同表明,睡眠是多尺度机制协同整合的动态过程,为理解睡眠功能及相关疾病提供了新的理论视角。
近日,中国科学院脑科学与智能技术卓越创新中心刘丹倩研究员在国际期刊 Trends in Neurosciences 和 Free Radical Biology and Medicine发表两篇综述论文,从多角度阐述睡眠研究的前沿进展,并提出大脑调控睡眠的前瞻性理论框架。发表于Trends in Neurosciences的综述创新性地提出快速眼动(REM)睡眠的“层级调控框架”,系统阐明脑干、下丘脑、皮层及神经调质系统构成的协同网络与功能组织。
另一篇发表于Free Radical Biology and Medicine的综述深入阐释了活性氧(ROS)作为睡眠稳态调控的关键信号,作用于促睡眠环路驱动睡眠发生的生理功能。
两项工作共同表明,睡眠是多尺度机制协同整合的动态过程,为理解睡眠功能及相关疾病提供了新的理论视角。


REM睡眠的复杂性与层级调控
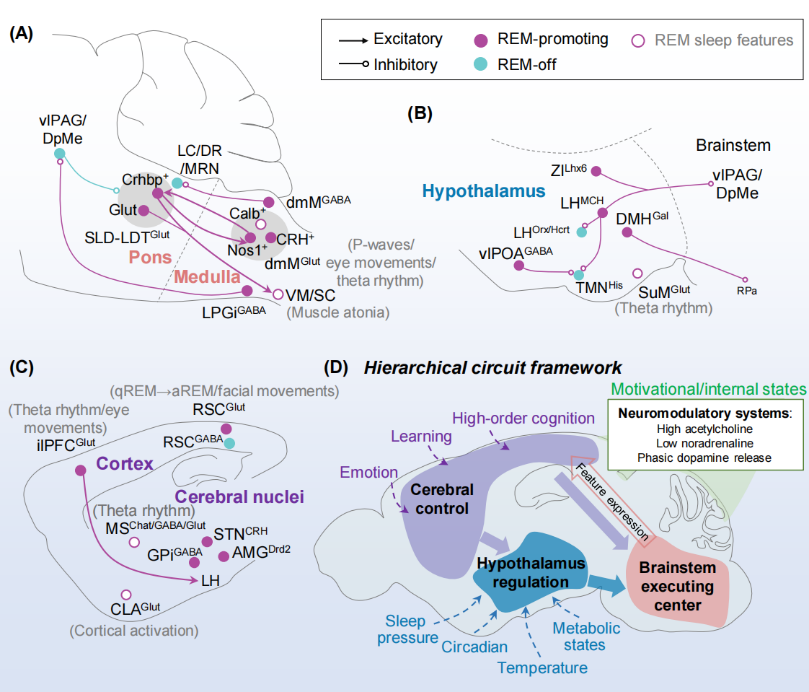
刘丹倩组在 Trends in Neurosciences 发表的综述论文Cracking the complexity of REM sleep,系统梳理了快速眼动(rapid eye movement, REM)睡眠的重要进展,并首次提出“层级调控框架”,为系统认识REM睡眠提供了全新的概念基础。
REM睡眠是梦境主要发生的阶段,由多种神经振荡与行为事件构成。海马θ节律、脑桥PGO波(Ponto-geniculo-occipital waves)与皮层慢波等协同作用,同时伴随快速眼动、面部抽动等行为特征,形成丰富的亚状态结构。
发育与演化研究显示:新生儿中REM睡眠的肌张力缺失、快速眼动等核心特征按序成熟;章鱼、蜥蜴等非哺乳类动物也具有“REM样睡眠”,呈现物种特异的行为模式。这些提示,REM睡眠是由多个特征共同构成的多组分动态过程。
随着光遗传学、环路追踪等技术的发展,REM睡眠的调控网络已从单一中心扩展为跨全脑的分布式体系。为理解这一复杂网络的组织原理,该综述提出了全新的层级化调控框架。
脑干:核心执行者。脑桥–延髓内分布着多个并行环路,分别控制肌张力缺失、快速眼动、PGO波等典型特征;这些环路之间紧密互作,共同起始与维持REM睡眠,是组织REM睡眠特征表达的关键。
下丘脑:生理整合中枢。下丘脑整合温度、代谢和昼夜节律等多种生理信号,并调控脑干网络,决定REM睡眠的发生时机与强度,实现与生理状态的动态适配。
大脑皮层:自上而下的精细调控者。压后皮层、前额叶皮层等高级脑区在 REM 睡眠中持续活跃,调节θ节律及亚状态切换,使REM睡眠能够根据情绪经历与认知需求进行灵活调整。
神经调质系统:全局调节器。胆碱能、去甲肾上腺素能和多巴胺系统以受体特异、时序敏感和环路特异机制,调控REM睡眠的启动与稳定性。
闭环光遗传等技术的发展,也使REM睡眠的功能逐步获得因果性验证。θ节律及其相位,以及前脑记忆相关环路的选择性激活,使REM睡眠可执行记忆巩固与遗忘的双重作用;前额叶皮层等脑区情绪处理相关神经元在REM睡眠高度活跃对于削弱负性情绪至关重要;而前扣带皮层等高级认知脑区在REM睡眠中的特异活动模式与推理和认知灵活性密切相关。
综述提出, REM睡眠在记忆、情绪与认知中的多样作用,本质上源于层级化调控网络的动态互作。未来研究应从追问“REM睡眠的整体作用”,转向解析“REM睡眠各组分如何被层级动态调控、以执行特定功能”。逐一揭示REM睡眠中θ节律、PGO波、快速眼动及关键神经环路的因果作用,将有望阐明大脑构筑REM睡眠的核心逻辑,并为破解梦境机制、情绪障碍以及认知灵活性等重大科学问题开辟新方向。
ROS:睡眠稳态调控的关键机制
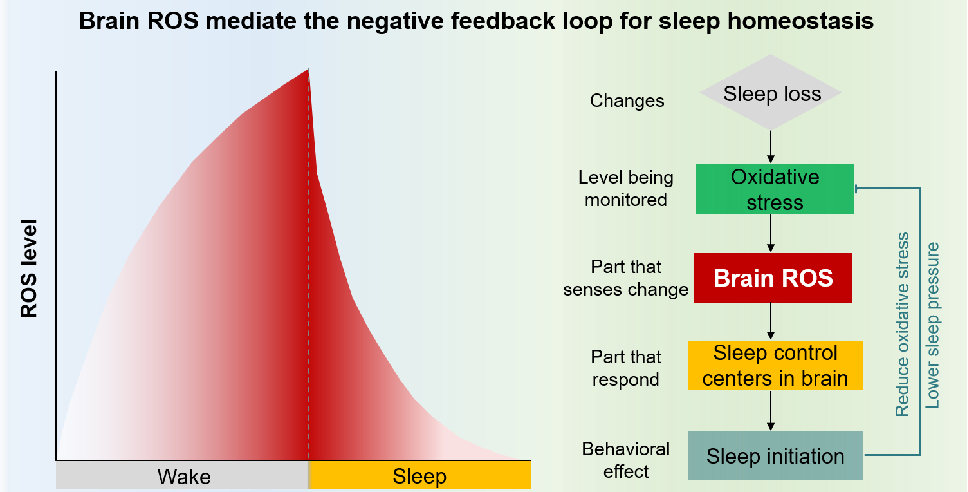
刘丹倩组在Free Radical Biology and Medicine发表的综述论文Physiological roles of reactive oxygen species in sleep homeostasis,从环路与分子整合角度阐述了睡眠与氧化应激之间的双向调控关系。文章提出活性氧(reactive oxygen species, ROS)不仅反映睡眠压力,更是被睡眠调控环路读取、并转化为驱动睡眠发生的核心信号。
综述首先梳理了细胞类型特异的ROS荧光指示蛋白(如HyPer、roGFP2-Orp1)和高精度操控工具(如miniSOG、DAAO)的发展,并重点介绍了它们在活体大脑中的应用及局限性。对ROS的亚细胞水平在体实时监测与定量操控,为解析 ROS在睡眠-觉醒状态转换中的作用奠定了关键技术基础。
短期睡眠缺失会在特定神经元中诱发显著的ROS积累,触发可逆的应激反应,而长期缺失睡眠则导致持续氧化损伤、神经炎症和环路功能受损。跨物种证据进一步表明,ROS以细胞类型特异的方式编码“觉醒时长”。
例如,果蝇中线粒体ROS在促睡眠的 dFB 神经元中累积;而在小鼠中,延长清醒会使中脑促睡眠神经元的胞质 H₂O₂ 持续上升,并在睡眠中下降,从而精准刻画睡眠压力随时间的增长与释放。更为关键的是因果证据表明,在适度范围内的ROS(尤其是H₂O₂)可激活睡眠促进神经元、推动睡眠启动;而过量ROS则会破坏睡眠结构,导致睡眠碎片化。
这一“倒 U 型”规律揭示了ROS既是睡眠压力的编码者,也是睡眠稳态的核心调控器;维持ROS在生理感应范围内,对睡眠稳态和健康具有重要意义,并为理解氧化应激相关疾病中的睡眠障碍提供了新的思路。
总体而言,该综述提出,ROS是连接“为什么需要睡眠”与“睡眠如何被调控”的关键枢纽。通过将觉醒引发的氧化压力转化为睡眠驱动力,ROS在维持大脑代谢健康和生理稳态中发挥着核心作用。未来,识别ROS的分子信号靶点、解析细胞间氧化还原信号互作、以及建立跨物种研究框架,将推动对睡眠稳态机制的深入理解。
上述两篇综述从分子信号到神经环路等不同层次,对大脑调控睡眠的关键机制进行了系统剖析与理论更新,强调睡眠并非由单一机制主导,而是由分子、细胞、环路乃至全脑网络协同参与的动态过程。
随着多尺度技术的快速发展,未来围绕睡眠—代谢—脑功能的多层次整合研究将不断深化,有望推动睡眠医学、神经精神疾病干预以及脑健康维护策略的发展与创新。
论文相关研究受到国家科技创新2030重大专项、国家自然基金委等项目资助。
原文链接:
1.https://doi.org/10.1016/j.tins.2025.10.0082.https://doi.org/10.1016/j.freeradbiomed.2025.10.273
1.Dong Y, Liu D. Cracking the complexity of REM sleep. Trends Neurosci. 2025 Nov 6:S0166-2236(25)00221-8. doi: 10.1016/j.tins.2025.10.008. Epub ahead of print. PMID: 41203508.
2.Tian Y, Liu X, Liu D. Physiological roles of reactive oxygen species in sleep homeostasis. Free Radic Biol Med. 2025 Oct 22;242:220-236. doi: 10.1016/j.freeradbiomed.2025.10.273. Epub ahead of print. PMID: 41135839.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


