Hans Clevers合作团队新进展!Nature子刊:具备免疫系统的类器官可评估肿瘤免疫治疗脱靶效应
来源:生物谷原创 2024-01-04 15:24
通过招募免疫细胞靶向肿瘤,癌症免疫治疗已成为目前对抗癌症最有前途的策略之一。尽管显示出良好的临床疗效,但由于癌症细胞和免疫抑制肿瘤环境中新抗原的低表达等因素影响,肿瘤免疫疗法只对一小部分患者和肿瘤亚群
通过招募免疫细胞靶向肿瘤,癌症免疫治疗已成为目前对抗癌症最有前途的策略之一。尽管显示出良好的临床疗效,但由于癌症细胞和免疫抑制肿瘤环境中新抗原的低表达等因素影响,肿瘤免疫疗法只对一小部分患者和肿瘤亚群有效。此外,免疫毒性也是抗癌免疫药物临床应用的主要障碍。几乎所有靶向T细胞的药物,如免疫检查点抑制剂、CAR T细胞和T细胞双特异性抗体(T-cell-engaging bispecific antibodies, TCBs)等,都会在健康组织引起严重的不良反应,限制免疫疗法的广泛应用。然而,这些免疫治疗的问题通常是传统临床前毒理学模型无法预见的。无论是细胞还是动物,传统的疾病模型一方面不能捕捉到天然器官的复杂性,一方面缺乏人类特异性组织特征和免疫反应。
源自患者的类器官(Patient-derived organoids),由于能够保存亲代组织的形态、遗传和功能特征,正逐渐成为强大的临床前模型。已有大量研究证明,类器官可以准确预测患者对抗癌药物的反应,凸显其在肿瘤学研究和个性化医学中的价值。尽管类器官本身缺乏免疫系统,但通过与免疫细胞共培养,可以使类器官用于化疗、靶向治疗和免疫治的临床前测试。相关研究均表明类器官可用于测试和提高癌症免疫治疗药物的疗效,并针对有良好体外药物反应的患者调整其治疗方案。然而,目前基于类器官的肿瘤免疫模型在很大程度上忽略了癌症免疫疗法在健康组织中的毒性,是相关药物有效临床转化的主要障碍。
罗氏公司近年加码布局类器官领域,2022年聘请了类器官鼻祖Hans Clevers担任罗氏药物研究和早期开发部门(Pharma Research and Early Development, pRED)负责人,2023年5月宣布成立人类生物学研究所(Institute of Human Biology, IHB)。IHB作为药物研究和早期开发部门的一部分,专注于包含类器官在内的人类疾病模型研究,加速药物研发。
罗氏公司、巴黎萨克雷大学和巴塞尔大学合作,发现具备免疫系统的患者来源肠道类器官和肿瘤类器官,可用于研究T细胞双特异性抗体的肿瘤免疫治疗脱靶效应,并获得传统疾病模型无法预测的临床毒性和患者间药物反应差异性。相关成果以“Analysis of off-tumour toxicities of T-cell-engaging bispecific antibodies via donor-matched intestinal organoids and tumouroids ”为题目,于2023年12月19日发表于Nature Biomedical Engineering杂志上,本文通讯作者是罗氏公司药物研究和早期开发部门的Nikolche Gjorevski。

用于评估T细胞双特异性抗体(TCB)药效的类器官模型构建
研究团队利用手术切除的小肠和结直肠组织培养肠道类器官,评估了TCB的两个靶蛋白CEA(carcino-embryonic antigen)和EpCAM(epithelial cell-adhesion molecule)在类器官中的表达,并将其与亲代肠道样本的表达情况进行了比较。组织学评估显示,EpCAM和CEA均存在于健康的肠道组织中。而两种靶蛋白在对应的类器官中,以体内相似的形态学模式表达:EpCAM定位于细胞连接中,而CEA显示出顶端(apical)定位。
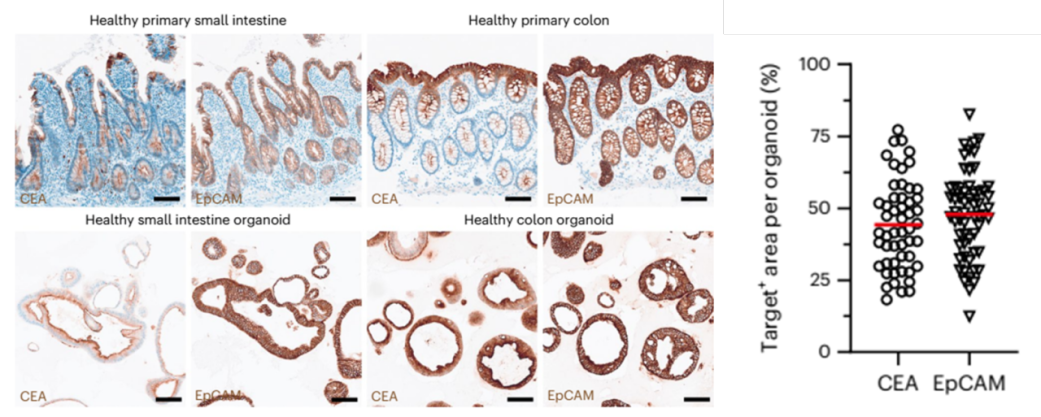
肠道组织及类器官中CEA和EpCAM表达谱
doi: 10.1038/s41551-023-01156-5
本文的共培养模型有何特点?
传统的类器官共培养模型中,类器官与免疫细胞共处在悬浮培养基或者培养板底部。本文的研究团队,将患者来源肠道类器官与外周血单核细胞(Peripheral blood mononuclear cell, PBMC)共同封存在固态3D水凝胶(一种collagen I和Matrigel的混合物)中进行培养。这样形成的固态细胞外基质,可以有效重现肠道组织的机械力特征,进而在体外模拟接触依赖性靶向以外的关键免疫过程,包括旁观者信号传导、免疫细胞迁移和免疫细胞渗透等。
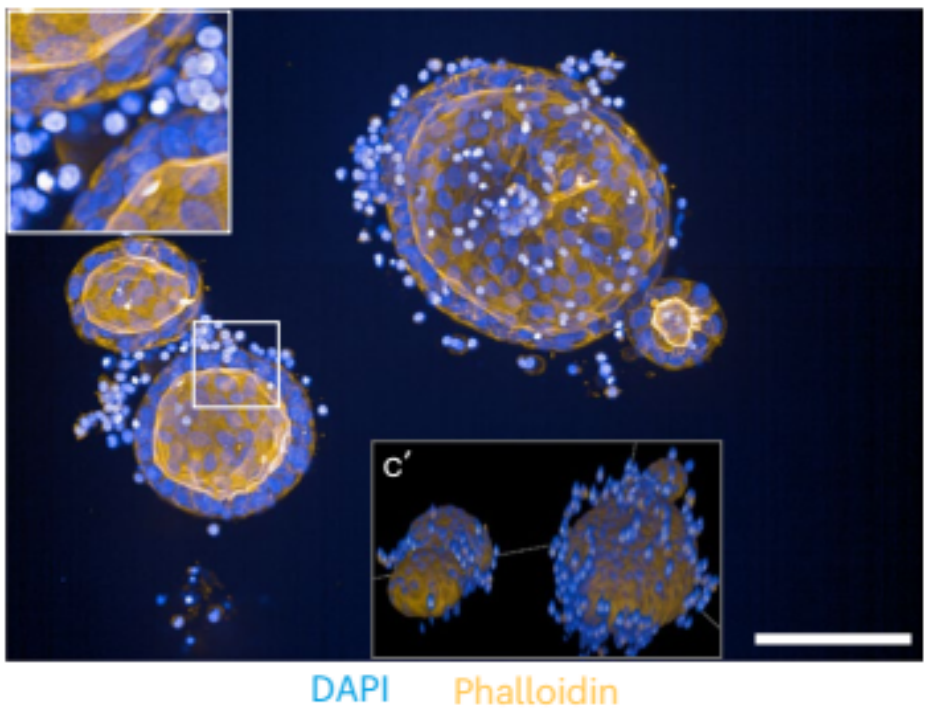
共培养模型的免疫染色结果
(蓝色:细胞核,橙色:细胞骨架)
doi: 10.1038/s41551-023-01156-5
基于共培养模型研究T细胞双特异性抗体的药效机制
为了研究T细胞双特异性抗体介导的免疫细胞激活机制以及脱靶毒性,研究团队使用流式细胞术和多重免疫荧光,揭示了一个级联反应:① CD4+辅助性T细胞和CD8+杀伤性T细胞浸润到类器官,②T细胞活化,③释放炎性细胞因子(特别是干扰素-γ、白细胞介素6、白细胞介素8以及肿瘤坏死因子),④细胞凋亡。
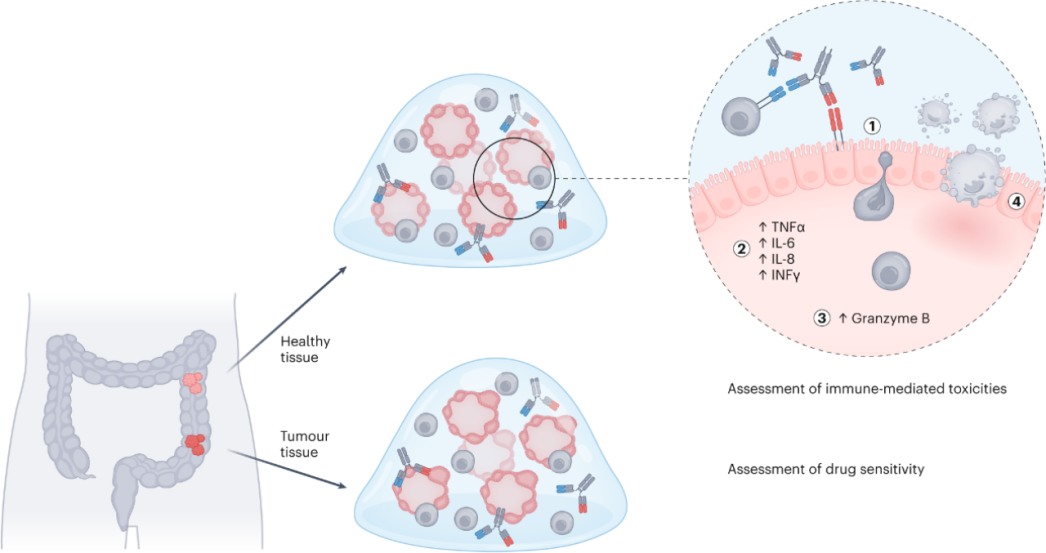
T细胞双特异性抗体介导的免疫反应示意图
doi: 10.1038/s41551-023-01163-6
展望:类器官在药物研发和药效评估方面的床应用
由于对肿瘤免疫学和肿瘤微环境认识不足,肿瘤限制性抗原稀缺、临床前模型缺陷和临床应用缺乏指导等因素,癌症免疫疗法尚未充分发挥其潜力,在治疗实体瘤体现的尤为明显。
罗氏公司领衔的这项研究表明,使用基于类器官的药效评价工具,可以在以下三个方面拓展癌症免疫治疗药物的应用能力:
(1)对药物疗效和安全性进行更准确的临床前评估
(2)在细胞和分子层面,阐明免疫介导的肿瘤与健康细胞的杀伤机制
(3)指导个性化精准用药
参考文献:
1.https://www.roche.com/about/leadership/hans-clevers
2.https://www.roche.com/media/releases/med-cor-2023-05-04
3.https://www.nature.com/articles/s41551-023-01156-5
4.https://www.nature.com/articles/s41551-023-01163-6
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


