Nature子刊:西湖大学付向东团队揭示CSB蛋白调控衰老与癌症的共同机制
来源:生物世界 2024-07-30 11:29
研究团队运用了R-ChIP、ChIP-seq、PRO-seq等高通量测序技术,并结合体外转录系统和机器学习算法,全面解析了CSB在转录调控和基因组稳定性维持中的核心作用。
近日,西湖大学付向东教授团队联合加州大学圣地亚哥分校王栋教授团队,在 Nature Communications 期刊发表了题为:Cockayne Syndrome Linked to Elevated R-Loops Induced by Stalled RNA Polymerase II during Transcription Elongation 的研究论文。
该研究以R-loop结构为锚点,深入探讨了CSB蛋白分别在小鼠和人源神经元细胞基因组复制和转录过程中的调控作用,揭示了CSB基因突变导致衰老以及癌症的过程中可能存在共同病理机制。

研究团队运用了R-ChIP、ChIP-seq、PRO-seq等高通量测序技术,并结合体外转录系统和机器学习算法,全面解析了CSB在转录调控和基因组稳定性维持中的核心作用。他们发现,CSB缺陷会导致RNA聚合酶II(RNAPII)在转录延伸过程中,特别是在T-run序列区域出现暂停,进而引发R-loop(RNA-DNA杂合结构)的形成,最终加剧基因组不稳定性。
首先,研究团队利用之前开发的R-loop高分辨率测序技术R-ChIP,分析发现CSB敲低导致R-loop数量和大小均增加。ChIP-seq数据显示,CSB结合位点与R-loop和RNAPII暂停位点高度重合,尤其是在基因体(Gene bodies)内。并且,CSB敲低导致RNAPII信号显著减弱,这种现象在RNA 转录本3'端尤为明显。此外研究团队发现,许多由CSB敲低诱导新生成的R-loop都包含T-run序列。为验证T-run序列导致RNAPII暂停的假设,他们设计了体外转录实验并观察到T-run序列确实引发了RNAPII暂停,而添加Rad26(CSB的酵母同源物)能显著缓解这种暂停。
由于CSB缺陷与神经病理学表型密切相关,因此研究团队在多种来源的小鼠和人源神经细胞进行转录组分析,发现CSB敲低主要影响神经元功能相关的长基因表达。在人源细胞中,这些基因表达显著下调;而在小鼠细胞中,由于进化导致的内含子长度差异,CSB敲低对小鼠基因表达的影响较为有限。上述跨物种的表型差异有助于回答为什么CSB基因突变在小鼠中主要引发癌症,而在人类中却导致早衰和严重的神经发育缺陷的科学问题。
这项研究深入揭示了CSB通过帮助RNAPII克服转录障碍来维持基因组稳定性的机制。当CSB缺失时,RNAPII在这些位点暂停,导致R-loop形成,进而引发基因组不稳定。这一机制解释了为何CSB缺陷在人类中主要影响神经系统,而在小鼠中则主要导致癌症。
更为重要的是,这项研究为理解衰老和癌症之间的内在联系提供了全新视角。基因组不稳定性作为衰老和癌症的共同特征,而CSB通过精密调控R-loop形成来维持基因组稳定,在这一过程中扮演了关键角色(图1)。该研究也为探索基因组不稳定性相关的衰老和癌症的防治提供了新思路,有望通过精准调控R-loop形成从而减缓衰老进程或抑制癌症发展。
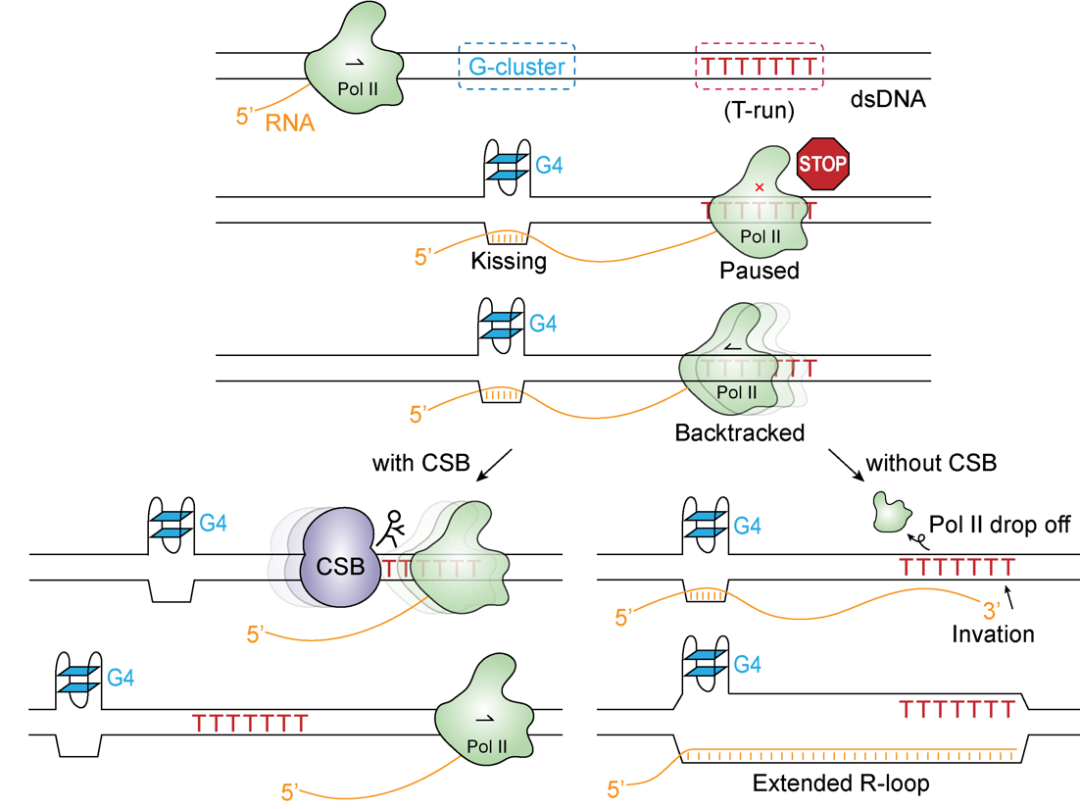
图1:转录延长过程中T-run区域依赖CSB的R-loop形成机制
该研究由西湖大学付向东课题组和加州大学圣地亚哥分校王栋课题组共同完成。加州大学圣地亚哥分校张璇博士、浙江大学医学院/转化医学研究院许军研究员和电子科技大学医学院胡婧研究员为论文共同第一作者。付向东教授和王栋教授为本文的论文共同通讯作者。加州大学圣地亚哥分校张思韬博士、张东阳博士、中国科学院北京基因组研究所(国家生物信息中心)郝亚静研究员和电子科技大学医学院钱浩教授在该研究中有重要贡献。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


