Nature Aging:免疫系统衰退的幕后推手Sema4A缺失如何加速衰老进程?
来源:生物探索 2025-02-09 14:47
研究人员发现了一种名为Semaphorin 4A(Sema4A)的分子,它在调节这些髓系偏向性造血干细胞的功能中扮演了至关重要的角色。
在我们体内,造血干细胞(Hematopoietic Stem Cells, HSCs)起着至关重要的作用,它们是血液细胞的源头,不仅负责血液中的红细胞、白细胞和血小板的不断更新,还帮助维持免疫系统的健康。随着年龄的增长或在长期的炎症环境中,这些造血干细胞的功能可能会受到严重影响,进而导致一系列健康问题,包括免疫衰退和血液系统疾病。尤其是那些偏向产生髓系细胞(myeloid cells),如中性粒细胞和血小板的造血干细胞(myeloid-biased HSCs),它们在老年和慢性炎症的背景下,往往比其他类型的造血干细胞更加脆弱。
Nature Aging的研究报道“Niche-derived Semaphorin 4A safeguards functional identity of myeloid-biased hematopoietic stem cells”,研究人员发现了一种名为Semaphorin 4A(Sema4A)的分子,它在调节这些髓系偏向性造血干细胞的功能中扮演了至关重要的角色。通过与其受体Plexin D1的相互作用,Sema4A能够为这些细胞提供保护,帮助它们应对炎症带来的压力。这项发现的重要性不仅在于它揭示了一个全新的细胞调节机制,还为衰老过程和炎症相关疾病的治疗提供了新的思路。
随着年龄的增长,体内的免疫系统逐渐衰退,髓系偏向性造血干细胞的数量和功能也开始下降。研究发现,缺乏Sema4A的小鼠在衰老过程中表现出异常的髓系扩展和免疫衰退现象。具体来说,这些小鼠在衰老过程中出现了过度的中性粒细胞和血小板增多,并且其骨髓中髓系与红系(M:E)细胞的比例显著增加,类似于一些骨髓增生性疾病的特征。更重要的是,随着年龄的增长,缺乏Sema4A的小鼠不仅失去了造血干细胞的自我更新能力,还出现了过度的分化,导致再生能力的丧失。
该研究揭示了Sema4A不仅仅是神经和血管生长的调节因子,也可能是我们保持健康、抗衰老和应对炎症挑战的关键。通过深入理解Sema4A如何保护造血干细胞免受衰老和炎症的影响,未来的医学研究或许能够开发出新的治疗策略,帮助我们在老化过程中维持更强的免疫系统和更健康的血液细胞功能。

造血干细胞与免疫衰退:为什么它们对我们的健康至关重要
造血干细胞(Hematopoietic Stem Cells, HSCs)是我们身体的“血液工厂”,负责生成所有类型的血液细胞,包括红细胞、白细胞和血小板。在免疫系统中,HSCs是至关重要的,因为它们不仅为身体提供持续的免疫细胞供应,还帮助维持血液循环和免疫防御。通过不断自我更新和分化,造血干细胞能够确保在任何时候,免疫系统都能发挥其应有的作用,迅速应对外界病原体的入侵。
然而,随着年龄的增长,特别是在长期的炎症环境中,造血干细胞的功能会逐渐受到损害。衰老过程对造血干细胞的影响十分深远,不仅降低了它们的再生能力,还加速了免疫系统的衰退。研究显示,随着年龄的增加,造血干细胞中的髓系偏向性(myeloid bias)显著增强,导致血液系统中中性粒细胞和血小板数量异常增多,而对淋巴细胞(如T细胞和B细胞)的生成则显著减少。这种不平衡的血液组成,反映了免疫系统功能的衰退。
在慢性炎症的背景下,这种衰退现象尤为显著。长期的低度炎症不仅加速了造血干细胞的衰老,还促使它们过度分化为髓系细胞。
Sema4A:一个意想不到的“保护因子”
Semaphorin 4A(Sema4A),一个可能并不为大众所熟知的分子,却在保持造血干细胞(HSCs)功能中发挥着至关重要的作用。Sema4A最初以其在神经发育和免疫系统中的作用而闻名,但最新的研究发现,它同样在骨髓中的造血系统中扮演了一个“保护因子”的角色。通过对小鼠模型的深入研究,研究人员揭示了Sema4A如何通过其与特定受体的相互作用,保护造血干细胞免受衰老和炎症压力的侵害。
Sema4A的作用主要通过其与细胞表面受体Plexin D1的结合来实现。Plexin D1受体在多种细胞类型中表达,尤其是在造血干细胞(HSCs)和髓系偏向性造血干细胞(myeloid-biased HSCs)中具有较高的表达水平。研究表明,Sema4A与Plexin D1的结合,能启动一系列信号传导通路,这些信号对于维护myHSC的“功能身份”(functional identity)至关重要,帮助这些细胞抵抗衰老和外界压力。
Sema4A缺失的后果:衰老和炎症如何加速造血干细胞的衰退
缺失Sema4A的研究小鼠为我们揭示了一个令人震惊的现象:髓系偏向性造血干细胞(myeloid-biased HSCs)在衰老和炎症的影响下,表现出过度扩展并迅速失去功能。这一发现不仅深刻揭示了Sema4A在维护造血干细胞功能中的重要性,还为我们理解衰老过程中免疫系统的变化提供了新视角。
在小鼠实验中,研究人员通过观察缺失Sema4A的小鼠,发现这些小鼠在衰老过程中出现了显著的血液异常。特别是在74周龄的小鼠中,中性粒细胞(neutrophils)和血小板(platelets)数量明显增加,同时血液中的红细胞数量却显著减少。这些变化反映了髓系细胞的过度扩展,以及红系细胞生成的明显不足。这些小鼠的骨髓中髓系细胞与红系细胞的比例(M:E比)出现了极度失衡,进一步加剧了免疫系统功能的衰退。
通过对比正常小鼠和Sema4A缺失小鼠的血液参数,研究发现,缺失Sema4A的小鼠不仅出现了中性粒细胞和血小板的过度生成,还在造血干细胞的谱系上表现出异常的扩展。特别是在衰老小鼠中,这种髓系偏向的扩展更为显著,导致免疫系统的自我修复能力下降,甚至出现了类似于骨髓增生性疾病的特征。这种血液异常的产生不仅仅是由于造血干细胞数量的增加,而是因为在Sema4A缺失的情况下,myHSCs倾向于向髓系方向过度分化,从而加速了衰老过程。
进一步的研究还揭示了Sema4A缺失对免疫细胞功能的影响。在缺乏Sema4A的衰老小鼠中,尽管髓系细胞增多,但B细胞和T细胞的数量却显著下降,这表明Sema4A在维持免疫多样性和防御功能中的不可或缺的角色。特别是,在长期炎症状态下,Sema4A的缺失加剧了这种偏向性扩展,使得免疫系统的整体功能受到压制。
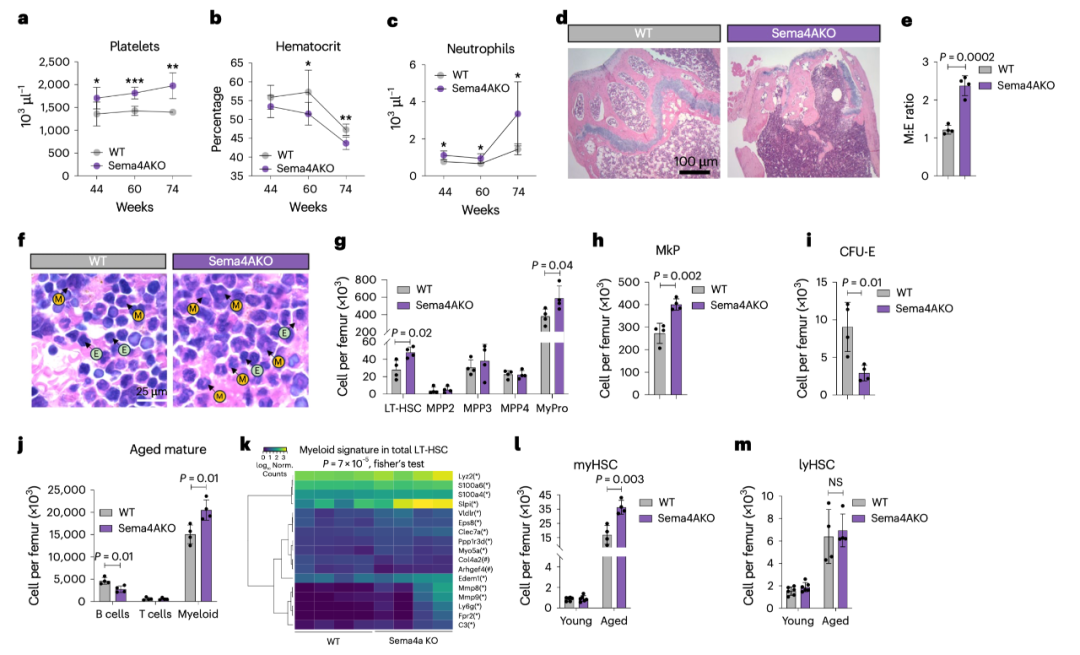
Sema4A缺失导致过度的髓系扩展以及早期衰老类似的造血表型(Credit: Nature Aging)
外周血中的血小板计数、中性粒细胞计数和血红蛋白浓度
在Sema4A缺失小鼠(Sema4AKO)中,随着年龄的增长,血小板计数(a)、血红蛋白浓度(b)和中性粒细胞计数(c)均显著增加。特别是,在60周龄和74周龄的Sema4AKO小鼠中,这些血液参数与对照组小鼠(WT)相比有显著差异(P值分别为0.02到0.002),表明Sema4A缺失促进了髓系细胞的过度增生。
骨髓的形态学变化
通过H&E染色观察,Sema4A缺失的小鼠骨髓表现出典型的髓系细胞(M)和红系细胞(E)比例失衡。图中(d、f)显示了Sema4AKO小鼠骨髓中髓系细胞的显著扩展和红系细胞的相对减少,进一步证实了髓系偏向性增强。
髓系/红系比(M:E比)
在Sema4A缺失的衰老小鼠骨髓中,M:E比显著增高(e),这表明髓系细胞的过度扩展,而红系细胞的生成受到抑制。
造血干细胞和祖细胞的数量变化
Sema4A缺失的小鼠骨髓中,髓系偏向的造血干细胞(myHSCs)的数量显著增加(l),而淋巴系偏向的造血干细胞(lyHSCs)的数量变化不大(m)。这些结果表明,Sema4A缺失导致了髓系偏向的造血干细胞数量的过度扩展,进一步验证了髓系细胞扩展的失调。
造血干细胞谱系的分布
在骨髓中,myHSCs和淋巴系造血干细胞(lyHSCs)的数量对比进一步显示了Sema4A缺失对髓系细胞的过度偏向(g、h)。特别是髓系前体细胞(MyPro)和红系前体细胞(CFU-E)的数量变化,也支持了Sema4A缺失与髓系扩展的关系。
髓系特征的基因表达变化
通过RNA测序数据,研究还分析了已知的髓系特征基因,进一步确认了在衰老Sema4AKO小鼠中,髓系分化特征的增强(k)。这种基因表达模式与髓系扩展的现象密切相关。
细胞命运失控:Sema4A如何保持造血干细胞的“身份”不变
在众多造血干细胞中,髓系偏向性造血干细胞(myeloid-biased HSCs)尤为特殊,它们偏向于生成中性粒细胞和血小板等髓系细胞。然而,保持这种“身份”的稳定对于免疫系统的平衡至关重要。
在正常情况下,Sema4A通过与其受体Plexin D1相互作用,帮助myHSC保持其功能多样性。研究显示,Sema4A不仅通过细胞信号传导路径,确保myHSCs能够维持其自我更新和分化能力,还通过调节基因表达来阻止其过早地走向衰退或过度分化。例如,Sema4A的信号传导能够抑制myHSCs向髓系方向的过度扩展,确保它们在长期内可以维持一定数量并持续发挥功能。
然而,在Sema4A缺失的情况下,myHSCs的功能和基因表达模式发生了剧变。研究发现,缺乏Sema4A的小鼠在myHSC的基因表达谱中出现了显著的变化。通过单细胞RNA测序分析,研究人员发现,Sema4A缺失的小鼠的myHSCs表现出高表达与炎症反应和髓系分化相关的基因(如AP-1家族转录因子Jun、Fos等),而与HSC活性和抑制分化相关的基因(如Relb、Stat1)则显著下调。这种基因表达的变化表明,Sema4A的缺失使得myHSCs在衰老和炎症条件下进入了不受控制的分化状态,导致它们过度偏向髓系分化。
此外,Sema4A缺失还导致了myHSCs的“功能衰竭”。在没有Sema4A的情况下,这些细胞不仅失去了对自身身份的控制,还出现了明显的过度增殖和分化,迅速消耗了其再生能力。数据表明,随着myHSCs的过度分化,它们逐渐失去了自我更新的能力,最终无法为机体提供足够的免疫细胞。这一现象的发生,反映了Sema4A在维持myHSC功能的长期稳定性中的重要性。
Sema4A通过调控myHSCs的命运,确保它们在面对衰老和炎症压力时,能够保持一定的“平衡”。当这一机制遭到破坏,myHSCs的命运便失控,最终导致免疫功能的衰退和血液系统的不平衡。
Sema4A的免疫保护作用:炎症反应中的关键调节因子
Sema4A不仅是保持造血干细胞(HSCs)功能稳定的关键分子,它在免疫系统的调节中也发挥着至关重要的作用,特别是在炎症反应中。炎症,无论是急性还是慢性,都会对造血干细胞造成显著的压力,导致其功能衰竭或不平衡。Sema4A通过多种机制保护myHSC(髓系偏向性造血干细胞)免受炎症损伤,确保免疫系统在面对外部威胁时依然能够高效运作。
在急性炎症反应中,Sema4A通过与其受体Plexin D1相互作用,调节myHSC的增殖与分化。当机体遭遇如细菌感染等急性免疫挑战时,myHSC的增殖通常会迅速增加,髓系细胞(如中性粒细胞)的生成也会随之加速。这一过程中,Sema4A通过有效调控细胞周期,避免了过度的细胞增殖和不必要的分化。研究表明,在急性免疫应答中,缺乏Sema4A的小鼠表现出myHSC的过度增殖,并且这些细胞难以恢复到其正常的稳态状态。实验数据显示,Sema4A缺失小鼠在接受LPS(脂多糖)刺激后,myHSC的增殖反应显著过度,导致细胞在急性炎症后难以恢复到正常水平。这表明,Sema4A不仅仅是抑制过度增殖的因子,它通过调节细胞周期,确保myHSC在应对急性免疫挑战时不会陷入自我耗竭。
在慢性炎症的背景下,Sema4A的作用更加突出。长期的低度炎症会加速造血干细胞的衰老,导致髓系偏向的细胞过度扩展,进而抑制其他血细胞谱系的生成。研究表明,Sema4A通过维持myHSC的基因表达稳定性,避免了其过度分化和功能衰竭。在慢性LPS处理的小鼠中,缺失Sema4A导致myHSC在骨髓中表现出异常的髓系扩展,同时伴随着B细胞和T细胞的显著减少,这反映了免疫系统多样性的丧失。特别是在这种慢性炎症状态下,Sema4A通过减少myHSC过度分化,保护了造血干细胞的长期再生能力。
进一步的分析还揭示,Sema4A通过调控myHSC的DNA修复途径和自我更新机制,帮助这些细胞在炎症环境中维持生存和功能。缺乏Sema4A的小鼠在炎症刺激下,显示出与DNA损伤修复相关的基因表达上调,如AP-1家族转录因子和EGR1,这些变化与细胞周期失控和炎症反应过度相关。同时,Sema4A通过其作用的Plexin D1受体,在应对炎症压力时发挥着保护作用,确保myHSC不会因过度激活而进入衰竭状态。
综合来看,Sema4A通过多重机制保护myHSC免受急性与慢性炎症的损伤。在急性免疫反应中,它有效地调控了细胞增殖,避免了过度的分化和衰竭;在慢性炎症中,它则帮助保持myHSC的平衡,防止功能丧失。
揭示Sema4A潜力的下一步研究
尽管目前的研究已经揭示了Sema4A在维持造血干细胞功能、保护免疫系统以及延缓衰老过程中的重要作用,但这仅仅是Sema4A在生物学领域潜力的冰山一角。未来的研究有望揭示更多关于Sema4A与其他细胞类型之间的复杂相互作用,进一步扩大其在生物医学领域的应用范围,特别是在癌症、免疫衰退及其他与衰老相关的疾病治疗中。
首先,Sema4A与免疫系统的相互作用不仅限于造血干细胞。已有研究表明,Sema4A通过与Plexin D1受体的结合,调节了包括免疫细胞(如T细胞、B细胞和树突状细胞)在内的多种细胞类型的功能。这些发现提示,Sema4A可能通过复杂的信号传导网络影响不同类型的免疫细胞的发育、功能和反应能力。因此,未来的研究还需要深入探讨Sema4A在这些细胞群体中的作用,特别是在免疫反应的调节、炎症反应中的作用以及免疫逃逸机制中的潜力。
例如,在癌症的免疫逃逸机制中,肿瘤细胞经常通过改变免疫系统的功能来逃避宿主免疫的监视。Sema4A是否在此过程中扮演角色仍需进一步探讨。有证据表明,Sema4A与肿瘤微环境中的免疫细胞相互作用,可能影响肿瘤的免疫逃逸和耐药性。如果Sema4A能够在免疫细胞与肿瘤细胞之间起到调节作用,未来或许可以通过调控Sema4A的表达或其信号通路,增强免疫治疗对肿瘤的效果。
此外,Sema4A的功能在衰老和免疫衰退中同样具有深远的影响。随着年龄的增长,免疫系统逐渐失去对病原的抵抗能力,Sema4A作为一种免疫调节因子,可能成为减缓免疫衰退的突破口。未来研究可以进一步探索Sema4A在衰老过程中的作用,特别是它如何通过维护免疫干细胞的功能来抵御衰老带来的免疫系统劣化。例如,Sema4A是否能够通过激活特定的免疫途径,修复或再生衰老免疫细胞,这一问题将是未来研究的一个重要方向。
另外,Sema4A可能在其他与衰老相关的疾病治疗中发挥作用,如阿尔茨海默病(Alzheimer's disease)和心血管疾病。这些疾病通常伴随着慢性炎症和免疫功能的下降,Sema4A在调节炎症反应和免疫细胞的功能中可能起着关键作用。因此,进一步探索Sema4A在这些领域的作用,将有助于我们为老年人群体提供更有效的治疗方案。
总的来说,Sema4A的研究前景广阔,未来的研究将继续深化我们对其在免疫调节、衰老过程、癌症及其他免疫相关疾病中的作用的理解。通过揭示Sema4A与不同细胞类型的相互作用,并探索其在疾病治疗中的潜力,我们有望开发出新的生物治疗策略,推动免疫治疗、抗衰老治疗及癌症治疗的进步。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


