Nucleic Acids Res | 破解60年难题!周小龙团队实现RNA定点高效乙酰化修饰
来源:生物探索 2024-05-10 09:35
该研究基于已解析和预测的酵母Kre33结构,构建并纯化了一个C -末端柔性结构域( flexible domain,FD )截短的Kre33。
中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周小龙团队在Nucleic Acids Research 上在线发表题为“Activity reconstitution of Kre33 and Tan1 reveals a molecular ruler mechanism in eukaryotic tRNA acetylation”的研究论文,该研究成功重组了酵母Kre33和Tan1的ac4C12修饰活性。ac4C12的生物合成主要依赖于一个最小的元件集,包括一个典型的受体茎,11CCG13基序的存在和正确的D臂方向,这表明了一个分子标尺机制。
单个A13G突变赋予ac4C12对多个非底物tRNA的修饰。此外,将ac4C修饰引入到小RNA中,ac4C12修饰在体外和体内对tRNA的解链温度和氨酰化修饰的贡献很小。总之,该结果实现了体外活性重构,揭示了ac4C12生物合成的tRNA底物选择机制,并开发了一个有价值的制备乙酰化tRNA和非tRNA RNA物种的系统,这将促进乙酰化在RNA结构和功能中的功能解释。

RNA上修饰了超过150种不同的化学修饰,统称为RNA RNA表观遗传学。在各种RNA类别中,转运RNA ( transfer RNAs,tRNAs )具有最广泛和多样的修饰,占鉴定到的修饰的80% 。
乙酰化是一种普遍存在的转录后修饰,存在于各种类型的RNA [信使RNA ( mRNA )、tRNA和核糖体RNA ( rRNA )]中,遍及生命的所有分支。迄今为止,已经报道了两个乙酰化残基,N6 -乙酰腺苷( ac6A )和N4 -乙酰胞苷( ac4C )。而ac6A只存在于古菌的tRNAs 中,ac4C则存在于生命体的所有结构域中。ac4C在人类mRNA编码区的优势分布是先前观察到的。之前已经观察到ac4C在人类mRNA编码区的优势分布。然而,最近的一项研究未能在生理条件下鉴定人和酵母mRNA中的ac4C位点。在哺乳动物和酵母的18S rRNA中也发现了ac4C的修饰,它有助于rRNA前体的加工和翻译的准确性。
在细菌tRNA中,ac4C只存在于延伸体甲硫氨酸tRNA的摆动位置(第34位, ac4C34)。在此位置,乙酰化主要由GCN5相关的乙酰转移酶TmcA催化。因此,ac4C34修饰可以通过TmcA在体外成功重组。对TmcA的生化和结构研究揭示了其催化机理,表明其利用乙酰辅酶A (作为乙酰基供体)和ATP作为底物。此外,最近的一项研究鉴定了枯草芽孢杆菌中负责ac4C34生物合成的甲硫氨酸tRNA胞苷乙酸酯连接酶( TmcAL )。对TmcAL活性的重构发现,TmcAL以乙酸盐为乙酰基供体,其催化机制( tRNA类氨酰化机制)和结构域组成与TmcA完全不同,ac4C34通过确保AUG Met密码子的精确解码,同时防止近同源AUA Ile密码子的误读,对翻译的准确性起着至关重要的作用。
古菌tRNA也存在ac4C修饰,但修饰位点更为多样,覆盖了多种古菌的多个tRNA。古菌ac4C修饰酶已被鉴定。古菌tRNA ac4C修饰在较高温度下受到刺激,乙酰转移酶缺陷型菌株表现出温度依赖性生长缺陷,表明温度依赖性ac4C生物合成是古菌独特的适应性生存策略。然而,ac4C修饰的缺失对古菌tRNA的熔解温度( Tm )没有影响。迄今为止,有关古菌ac4C修饰酶活性的体外研究尚未见报道。
ac4C水平的改变与多种人类疾病相关,包括炎症、糖尿病、肾衰竭、肺纤维化、多发性硬化症和各种感染。由于ac4C在mRNA、tRNA和rRNA上的广泛分布,ac4C相关疾病不能仅仅归因于tRNA的低修饰。然而,THUMPD1中的一系列双等位基因变异会损害其活性,并导致ac4C12修饰的丢失。这些变化导致了一种综合征形式的智力残疾,突出了tRNA ac4C12与人类疾病的直接关联。
尽管该领域对细菌ac4C34生物合成的分子机制及其在Met密码子解码中的生物学意义有了较为清晰的认识,但目前对真核生物ac4C12修饰的认识,包括修饰机制、tRNA底物选择、结构基础及其对tRNA结构和功能的影响等,仍然非常有限。此外,Tan1 / THUMPD1在ac4C12生物发生中的结构和功能知之甚少。此外,NAT10和THUMPD1致病变异的机制尚不清楚。这些局限性至少部分源于真核生物tRNA ac4C12修饰从未在体外重组。因此,最近一项研究ac4C12对tRNA热力学性质的潜在影响依赖于tRNA D - arm中含ac4C12片段的化学固相RNA合成,但不能利用完整的tRNA。由于未能制备出ac4C12修饰的tRNA,极大地阻碍了对ac4C12在tRNA结构和功能中的分子机制和潜在作用的理解。
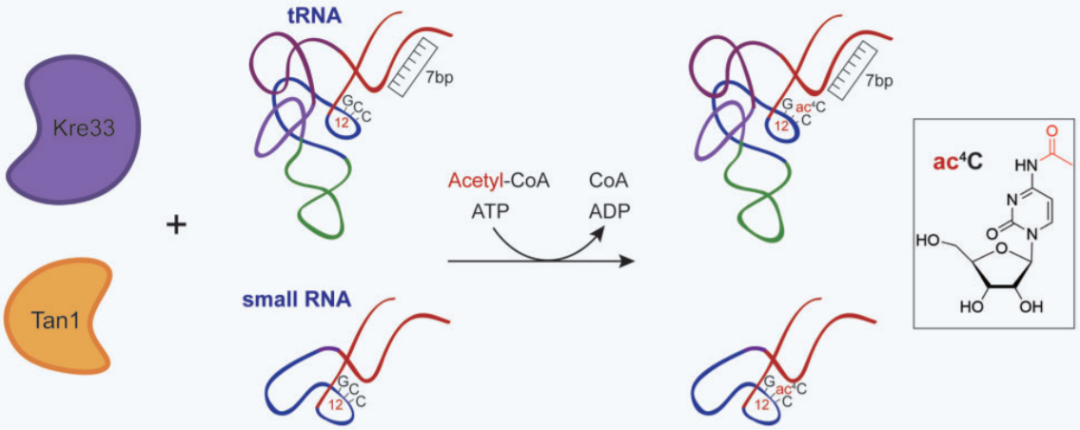
模式图(Credit: Nucleic Acids Research)
因此,该研究基于已解析和预测的酵母Kre33结构,构建并纯化了一个C -末端柔性结构域( flexible domain,FD )截短的Kre33。通过Kre33-Tan1活性成功重组了tRNASer和tRNALeu的ac4C12修饰。体外和体内数据表明,Tan1识别tRNA是通过协调的蛋白质- RNA相互作用介导的。现ac4C12至少在体外对tRNA转录本的Tm值没有影响,在体内和体外对tRNASer和tRNALeu的带电水平也没有影响。总之,该结果首次在体外重建了ac4C12的修饰,并提出了真核生物ac4C12生物合成中tRNA底物选择的原则,为进一步研究真核生物ac4C12修饰的分子机制、结构基础和功能意义以及ac4C12相关疾病的分子病因学奠定了坚实的基础。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


