《细胞》子刊:乳酸让PD-1抑制剂变身“毒药”
来源:奇点糕 2022-02-18 08:14
免疫检查点抑制剂(ICB)为临床肿瘤大夫装备了新的武器弹药,以便更有效地狙击肿瘤。PD-1抑制剂里面的佼佼者,也是最早通过临床实验用于治疗的药物。PD-1抑制剂的作用机制是靶向结合效应CD8+ T细胞上面的PD-1(促耗竭分子),以维持效应T细胞的存活及加强其杀伤肿瘤细胞的功能。但是,目前PD-1抑制剂治疗肿瘤的有效率还不足一半,这也
免疫检查点抑制剂(ICB)为临床肿瘤大夫装备了新的武器弹药,以便更有效地狙击肿瘤。PD-1抑制剂里面的佼佼者,也是最早通过临床实验用于治疗的药物。
PD-1抑制剂的作用机制是靶向结合效应CD8+ T细胞上面的PD-1(促耗竭分子),以维持效应T细胞的存活及加强其杀伤肿瘤细胞的功能。
但是,目前PD-1抑制剂治疗肿瘤的有效率还不足一半,这也是让无数科学家和临床大夫非常沮丧和头疼的问题。
为了进一步提高PD-1抑制剂在临床上的使用功效,大量的药物抵抗机制也被陆续发现,科学家也希望通过针对这些机制研发出更有效的协同治疗药物。
有趣的是,除了CD8+T细胞,科学家还发现Treg(调节性T细胞)也能表达PD-1分子,而且,PD-1+CD8+T细胞与PD-1+Treg细胞在肿瘤内的平衡决定了PD-1抑制剂对肿瘤患者的治疗是否有效[1]。可是,决定这种平衡的机制却不得而知。
近日,日本名古屋大学Hiroyoshi Nishikawa(西川博嘉)教授及其团队从代谢角度获得了重磅发现。该研究也发表于Cancer cell杂志[2]。
他们发现,在低葡萄糖的高糖酵解代谢肿瘤内,包括高MYC表达的肿瘤以及肝转移癌,Treg细胞会主动摄取乳酸,引起PD-1表达水平增加。在这种情况下,PD-1抑制剂治疗会激活PD-1+Treg,导致PD-1+CD8+T进一步被抑制,最终导致了治疗的失败。
因此,他们提出,在高糖酵解代谢的肿瘤微环境中,乳酸是决定Treg功能一个十分有效的检查点。
现在让我们来看看他们是如何开展这一研究的。
首先,Nishikawa团队检测影响Treg表达PD-1的因素。
通过GSEA分析Nishikawa和他的同事发现,相较于Treg细胞低表达PD-1(PD-1low Treg)的肿瘤组织,Treg细胞高表达PD-1(PD-1high Treg)的肿瘤组织表现出高糖酵解和MYC通路激活的转录表达谱。进一步分析发现,相较于MYC低表达(MYClow)肿瘤,他们在MYC高表达(MYChigh)肿瘤中观察到了更高比例的Treg细胞,而CD8+T细胞的比例降低,且PD-1+ Treg细胞占比也增多。
那么,为什么高糖酵解环境可以对CD8+T和Treg细胞的表现造成这么大差异呢?里面又隐藏着什么样的奥秘?
接下来,Nishikawa团队从非小细胞肺癌中分离出PD-1+ 和PD-1? CD8+ T ,以及PD-1+ 和PD-1? Treg这四种肿瘤浸润T细胞。
基因富集分析发现,MCT1(Slc16a1)在PD-1+ Treg细胞中高表达。这引起了Nishikawa团队的注意,因为MCT1是乳酸出入的通道,而乳酸是糖酵解的最终产物。那乳酸是不是有可能就是影响PD-1表达的始作俑者呢?
为了验证这一猜想,他们检测了肿瘤中的乳酸浓度,结果发现PD-1high Treg 肿瘤中乳酸浓度比PD-1low Treg肿瘤中明显更高。同时,也确定了PD-1+ Treg细胞能够能显着高表达与乳酸代谢相关分子(MCT1和LDHB),而PD-1+ CD8+T细胞中这些分子的表达量却呈现出下降趋势。CHIP-seq分析也发现slc16a1和与它的关系密切的分子bsg这两个基因序列中存在FOXP3结合位点[3]。
之后,在体外实验中,Nishikawa团队用不同浓度的乳酸去处理 CD8+ T细胞和Treg细胞,结果证明,Treg中PD-1的表达量随着乳酸浓度的增加而增高,而CD8+T中PD-1的表达量与乳酸浓度呈现出相反的关系。
下一步,Nishikawa团队去分析了MCT1分子与不同T细胞亚类PD-1表达量之间的关系。首先,他们用MCT1的抑制剂(AR-C155858,MCT1i)分别去处理CD8+T和Treg细胞。MCTi能够降低Treg表达PD-1,但CD8+T细胞表达PD-1却增高了。在高浓度的乳酸条件下,敲除Slc16a1的Treg对CD8+T的抑制能力也有所减弱。这些结果均表明MCT1在介导Treg在高乳酸条件下的功能起着重要的作用。
那么,PD-1抑制剂是否能够激活高乳酸条件下Treg的功能呢?
Nishikawa团队发现,在低乳酸条件下,PD-1抑制剂可以激活CD8+T细胞,但不影响Treg细胞对CD8+T细胞的抑制功能。
而在高乳酸的条件下,情况却发生了改变,使用PD-1抑制剂之后,Treg对CD8+T细胞的抑制作用会明显加强。这表明,在高乳酸环境中,PD-1抑制剂会更倾向激活PD-1+Treg细胞,因此CD8+T的功能会进一步被抑制。
前面也提到MYC与PD-1+Treg关系密切。接下来,为了进一步剖析MYC对T细胞上PD-1表达的影响。Nishikawa团队建立了MYC过表达MC38(MC-38Myc)和B16-OVA(B16-OVAMyc)细胞模型。
他们发现,相较于对照组,MC-38Myc和B16-OVAMyc在体内和体外都能够产生更多的乳酸。体内实验显示MC-38Myc不管在免疫缺陷鼠还是免疫正常鼠中,都会导致更大的肿瘤负荷。在免疫正常小鼠中,MC-38Myc肿瘤比对照组呈现出更少的CD8+T细胞浸润。
PD-1的表达趋势也与上面的发现一致,MC-38Myc组中的Treg细胞呈现出更高的表达量,而CD+8细胞上面的PD-1却明显减少。同样的现象也在B16-OVAMyc模型中复现。
之后,Nishikawa团队用PD-1抑制剂去处理MC-38Myc小鼠模型。结果显示,PD-1抑制剂处理后,小鼠肿瘤中的Treg细胞表达更多与激活和增殖相关的标志物(CTLA-4,ICOS,GITR和Ki67)。而PD-1抑制剂却没能够增加TNF-α+IFN-γ+CD8+T细胞的比例。
因此,根据这些发现,他们得到结论:在MYC高表达的肿瘤中,乳酸增加了Treg的PD-1的表达量,PD-1抑制剂能够激活Treg细胞,从而导致了PD-1抑制剂的失效。
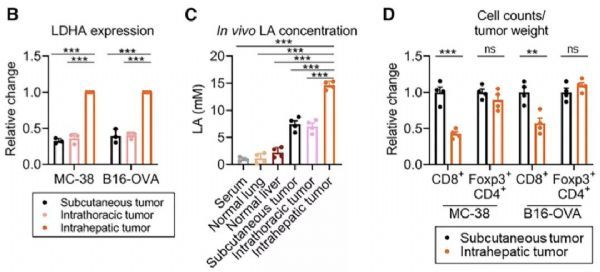
已有研究证明,肝转移癌中糖酵解水平很高[4]。在临床样本中,Nishikawa团队也发现Treg细胞PD-1表达量上调。
为了进一步确认这个现象,他们将MC38或者B16-OVA细胞分别于皮下,肺内或者肝脏内种植。相较于其它种植方式,肝内种植可以产生更高的乳酸。而且,与过表达MYC产生的影响一样,肝内种植方式能够减少PD-1在CD8+T细胞上表达,而增高其在Treg细胞上的表达。这样同样限制了PD-1抑制剂治疗的有效性。
既然PD-1+Treg细胞是导致PD-1抑制剂对MYC高表达肿瘤失效的罪魁祸首,那么,如果我们主动地去抑制其中Treg的功能,问题是不是就能够得到解决呢?
带着这个疑问,Nishikawa团队在MC-38Myc模型中敲减Ldha基因(MC-38Myc-LdhaRNAi),观察到相比于MC-38Myc,MC-38Myc-LdhaRNAi肿瘤表现出相反的特点,即:更多的CD8+T细胞浸润,CD8+T的PD-1表达量增多,Treg细胞功能减弱。
当用PD-1抑制剂去处理小鼠时,MC-38Myc-LdhaRNAi组小鼠的治疗功效大大提升。同样,如果运用乳酸抑制剂也能得到一致的结果。另外,他们也在MCT1(乳酸转运通道)阻断模型中观察到了一致的现象。
前面也提到,肝转移癌和MYC过表达模型呈现相似的特点。所以,Nishikawa团队同样将抑制乳酸和抑制MCT1模型运用到了肝转移癌实验中。实验结果很一致,即抑制乳酸或者MCT1均可增强PD-1抑制剂在肝转移癌中抗肿瘤作用。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。