Sci Adv│中国科学技术大学孙林峰课题组在人体锌离子转运机制研究中取得重要进展
来源:生物探索 2024-05-06 14:23
为了解决锌(Zn2+)外流的能量耦合器的争议,并揭示hZnT1的转运机制,本研究尝试纯化全长hZnT1,并使用基于细胞的体内和基于蛋白质脂质体的体外测定系统来确定其耦合机制。
中国科学技术大学孙林峰,刘欣及王兴兵共同通讯在Science Advances 发表题为“Structural insights into the calcium-coupled zinc export of human ZnT1”的研究论文,该研究展示了hZnT1作为锌(Zn2+)/钙(Ca2+)交换器的作用。该研究利用冷冻电子显微镜(cryo-EM)单粒子分析确定了hZnT1的结构。
hZnT1采用二聚体结构,每个亚单位包含一个由六个跨膜片段、一个细胞质域和一个细胞外域组成的跨膜结构域。跨膜区显示出一种向外呈现的构象。基于结构和功能分析,作者提出了一个关于hZnT1介导的锌(Zn2+)/钙(Ca2+)交换的模型。总的来说,这些结果有助于我们理解hZnT1的生物学功能,并为进一步研究ZnT家族转运蛋白提供了基础。
作为人类体内的一种重要微量金属离子,锌对于许多基本的生命过程至关重要,通过在维持大量蛋白质的正常结构和功能或细胞信号调节中发挥作用。锌的稳态受到几个因素的严格调控,包括称为金属硫蛋白(MTs)的非特异性金属结合蛋白,它们充当细胞内缓冲剂,以及两个胞膜内锌转运蛋白家族,即Zrt-和Irt-like蛋白(ZIP)家族,它从细胞外间隙或亚细胞器向细胞质输送锌,以及锌转运蛋白(ZnT)家族,它将锌从细胞质转运到细胞外环境或亚细胞器。
已经在人类ZnT家族中鉴定了十个成员,分别是ZnT1-ZnT10。在所有这些ZnTs中,人类锌转运蛋白1(hZnT1)是首先被发现的成员,主要功能在于细胞膜,因此在细胞锌平衡中起着关键作用。纯合子ZnT1基因敲除会导致小鼠胚胎致死,并且异常的hZnT1表达或功能已被发现参与多种病理生理过程,包括阿尔茨海默病(AD)、癌症、肥胖和糖尿病。据报道,hZnT1的表达水平在早期AD或晚期AD的易感脑区中显著升高,但在AD的临床前期或轻度认知障碍的个体中下降,这表明hZnT1与AD的发病密切相关。在几种癌症类型中,如前列腺癌以及肥胖症,hZnT1表达水平也被观察到显著上调。因此,针对hZnT1可能是相关疾病的诊断和治疗的一种有前途的方式。
尽管普遍存在并且对锌稳态至关重要,但hZnT1的转运和能量耦合机制仍存在争议。细菌同源物如YiiP以及某些hZnT成员如hZnT5和hZnT8已被证明是Zn2+/H+交换蛋白,它们利用质子动力驱动力将Zn2+从细胞内外输送。早期的研究利用人类胚胎肾细胞293T(HEK293T)基于荧光成像和基于脂质体的耦合质子转运测定法,使用从酿酒酵母中纯化的C端截短的hZnT1蛋白,也提出了hZnT1作为Zn2+/H+交换蛋白的观点,并且该过程与钠无关但对钙敏感。
值得注意的是,在细胞基础的试验中,当细胞外培养基中缺乏钙时,未观察到锌的外流,这被解释为Ca2+对hZnT1的转运活性具有促进作用。另一项使用神经元细胞基于荧光测量的研究表明,pH升高(从7.4升至8.0)对hZnT1介导的锌(Zn2+)外流几乎没有影响。相反,转运是与Ca2+有关的,Ca2+内流与Zn2+外流耦合,这表明在神经元细胞中hZnT1是一种Zn2+/Ca2+交换蛋白。因此,hZnT1的Zn2+外流的能量耦合机制有待进一步的表征,特别是通过体外分析,这样可以减少其他细胞因素的影响。
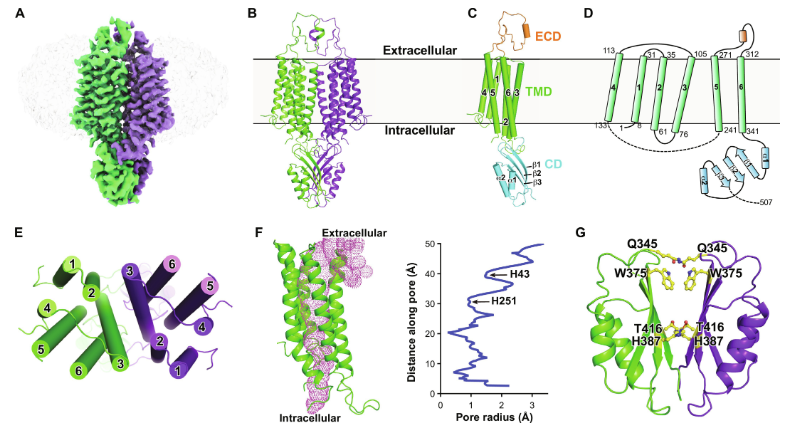
hZnT1的整体结构(Credit: Science Advances)
为了解决锌(Zn2+)外流的能量耦合器的争议,并揭示hZnT1的转运机制,本研究尝试纯化全长hZnT1,并使用基于细胞的体内和基于蛋白质脂质体的体外测定系统来确定其耦合机制。结果支持hZnT1作为Zn2+/Ca2+交换蛋白的功能。利用冷冻电子显微镜(cryo-EM)单粒子分析确定了hZnT1的结构,为进一步理解其转运机制提供了结构基础。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


