《自然》:免疫治疗认知大更新!科学家首次证实,肿瘤和血液中CD8+T细胞克隆多样性是免疫治疗的关键
来源:奇点糕 2023-03-15 17:39
基于接受PD-1抑制剂治疗的患者的肿瘤组织和血液样本,Puig-Saus等发现,无论癌症患者对免疫治疗是否有反应,他们体内都存在能识别肿瘤新抗原的效应T细胞,而且都是只识别少数新抗原;不过,不同反应
PD-1抑制剂正式被用于临床的时间,眼看就要满10年了。
这近10年间,以免疫检查点抑制剂为代表的免疫治疗给癌症治疗带来了翻天覆地的变化,很多癌症的临床治疗指南因此改写,无数患者因此获得新生。
以至于我们很多时候都忘记了,能从免疫治疗中获益的其实只有一小部分癌症患者,大部分患者对免疫治疗没有反应,有些患者接受治疗后甚至出现了疾病进展。
因此,从免疫检查点抑制剂用于临床治疗开始,科学家就在寻找背后的原因。一些重要的发现,在一定程度上改善了免疫治疗的效果。然而,获益患者少的局面仍没有被打破。
今天,顶级期刊《自然》杂志发表了加州大学洛杉机分校Antoni Ribas和Cristina Puig-Saus团队的研究成果[1]。
基于接受PD-1抑制剂治疗的患者的肿瘤组织和血液样本,Puig-Saus等发现,无论癌症患者对免疫治疗是否有反应,他们体内都存在能识别肿瘤新抗原的效应T细胞,而且都是只识别少数新抗原;不过,不同反应状态患者体内的效应T细胞多样性存在巨大差异。
具体来说,能从免疫治疗中获益的患者,单个新抗原对应着多样性的效应T细胞克隆(一种新抗原能被多种T细胞受体识别);而不能从免疫治疗中获益的患者,单个新抗原仅对应着少数效应T细胞克隆,甚至是单克隆(一种新抗原只能被一种T细胞受体识别)。
Puig-Saus团队的这项突破性研究,不仅让我们对患者的不同治疗反应有了新的理解,还为设计新型T细胞疗法指出了新方向。

论文首页截图
Puig-Saus团队开展的这个研究非常不易。
在他们开来,要想搞清楚免疫治疗后的新抗原特异性T细胞谱,至少有两个条件。
第一,需要一种极度灵敏的检测方法,能从少量血液样本的数百万个外周血单个核细胞(PBMCs)或少量活检肿瘤组织扩增的肿瘤浸润淋巴细胞(TILs)中,找到能识别数百种肿瘤新抗原的特异性效应T细胞。
第二,需要一种高效的新抗原特异性TCR(neoTCRs)的重建方法,在普通T细胞中逐一插入发现的neoTCRs,逐一验证功能,并系统性评估T细胞对匹配患者自体癌细胞系的识别和抗肿瘤活性。
在TCR-T细胞疗法公司PACT Pharma两项核心技术(ImPACT Isolation Technology®和PACT^NV™),分别帮助Puig-Saus团队解决了上述两个问题。
有了PACT Pharma的技术加持,Puig-Saus团队招募了11名接受过PD-1抑制剂治疗的黑色素瘤患者。其中患者1到患者7从免疫治疗中获得了持久的益处,生存时间在32个月到111个月之间,而且到本研究结束时所有患者依然存活;患者8到患者11,对免疫治疗没有反应,或者治疗后病情加重,在研究结束时这些患者都已去世。
研究人员还从所有患者身上采集肿瘤活检组织以及外周血,扩增了肿瘤浸润淋巴细胞,构建了癌细胞系,并给肿瘤组织和PBMCs做了全外显子组测序(WES)和RNA测序(RNA-seq)。工作量着实不小。
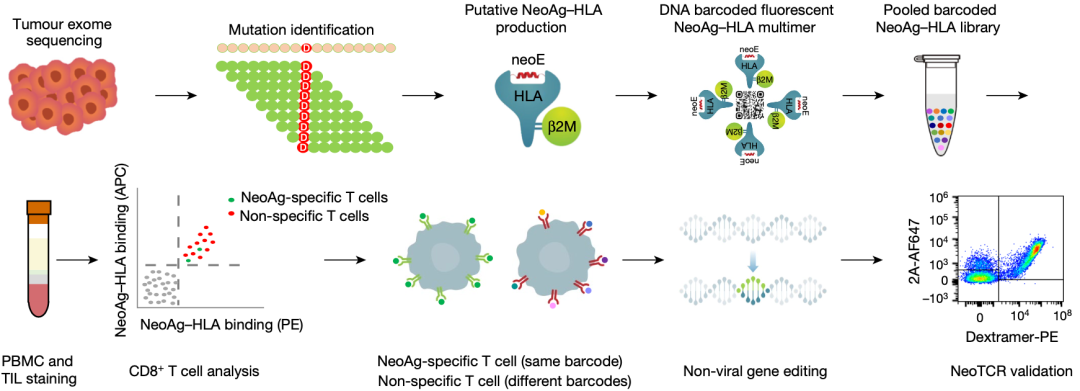
研究流程示意图
从WES数据来看,在所有患者体内发现的突变数量从31个(患者11)到3507个(患者1),中位数是380个。对免疫治疗有反应的7名患者中,非同义突变的中位数是506个;对免疫治疗没反应的4名患者这一数据为132个。虽然患者体内潜在的新抗原数量都不少,而且不同患者的变化非常大,但是被T细胞识别为新抗原的突变数量变化较小,从1到13不等。
在具体到TCR来看,对免疫治疗有反应的患者1-7体内,每个突变靶点对应的neoTCRs克隆型中位数是5种,每个患者体neoTCRs克隆型的中位数是41种。相比之下,四名对治疗没有临床反应的患者(8-11)体内,每个突变靶点对应的neoTCRs克隆型中位数是2种,每个患者体neoTCRs克隆型的中位数是6.5种。
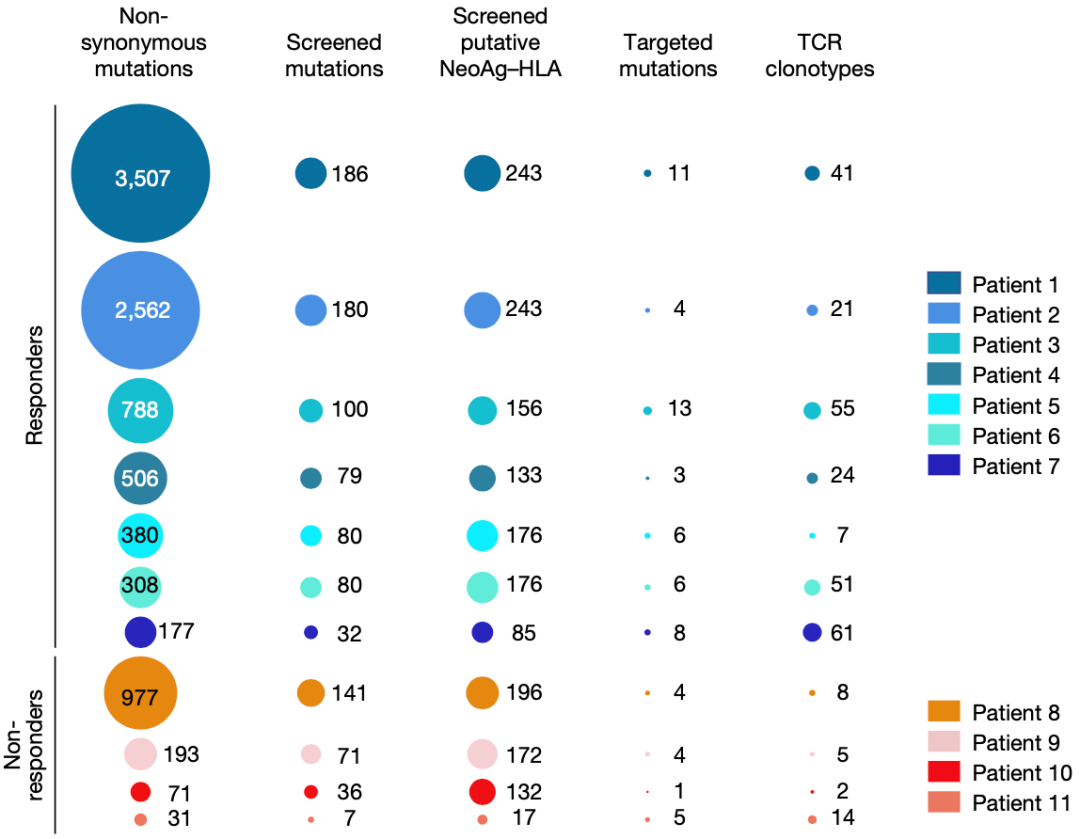
不同患者的突变数量及被T细胞识别的突变数量
在后续的研究中,Puig-Saus逐一研究了每个患者体内T细胞的情况。
就拿患者1来说,他们从患者体内分离到571个新抗原特异性T细胞,包括针对11个突变的41种不同neoTCR克隆型。他们还从中筛选了针对9个突变的22种neoTCR克隆型,并通过CRISPR基因编辑技术将它们分别整合到健康供体的T细胞中,以研究这些neoTCR克隆型的功能。
在分析患者1不同时间点的样品时,他们还发现识别NUP188、UBE2J1和WDR1三个突变新抗原的neoTCR克隆型反复出现。这说明针对癌细胞新抗原的效应T细胞在患者1体内存在普遍的扩增。他们基于患者2和6的样本也开展了类似的研究,也发现了患者特异性的neoTCR克隆型。
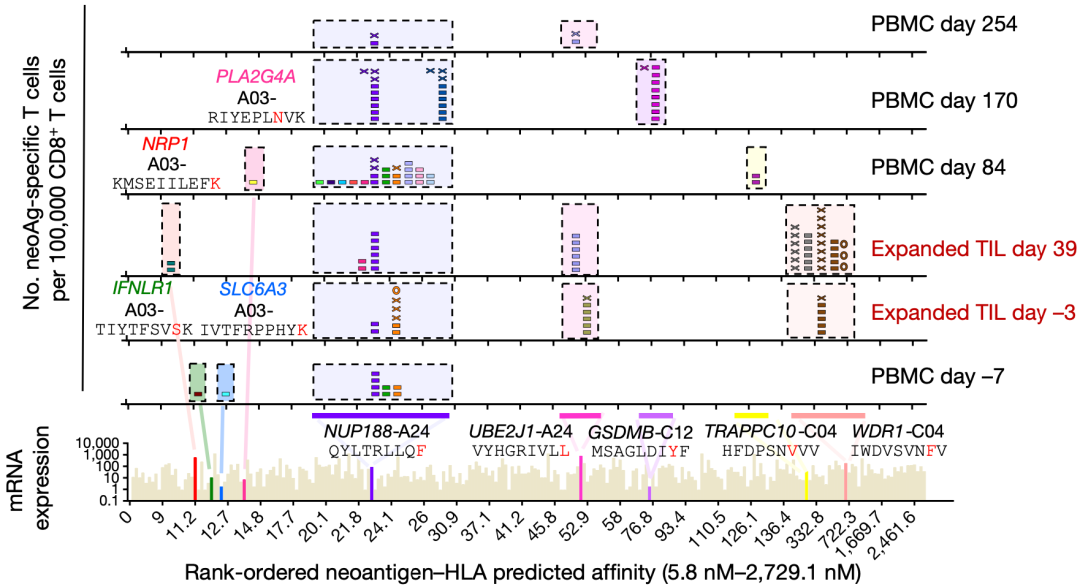
患者1特异性T细胞的动态变化
在验证患者1体内存在的neoTCR克隆型的功能时,他们发现靶向其中5个基因突变(NRP1、TRAPPC10、UBE2J1、NUP188和WDR1)的neoTCR-T细胞对患者自体癌细胞系(M495)有中等以上的细胞毒性,靶向剩余4个基因突变(IFNLR1、PLA2G4A、SLC6A3和GSDMB)的neoTCR-T细胞对M495没有细胞毒性。所有靶向9个基因突变的neoTCR-T细胞,都对非匹配的黑色素瘤细胞系(M202)没有细胞毒性。
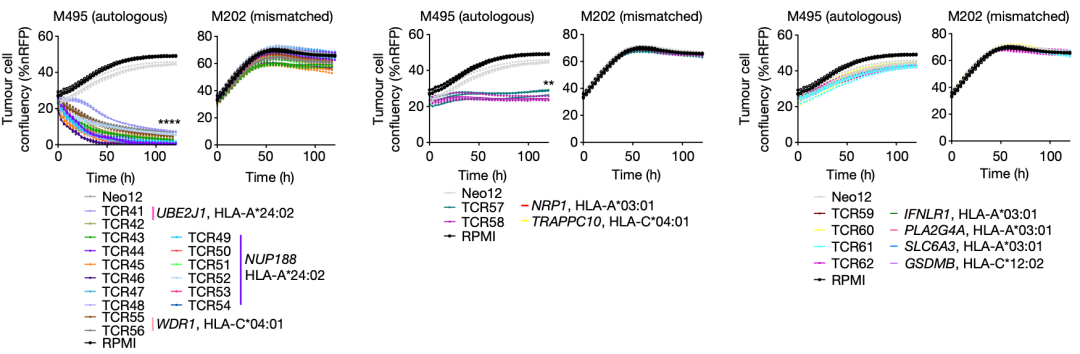
患者1的neoTCR克隆型功能验证
再来看不响应免疫治疗患者的数据。
在患者8的PBMC中只发现了8个neoTCR克隆型,它们分别针对NES、CTNNB1、POLR2G和SERPINH1四个基因突变。在患者9体内,发现了针对4个基因突变的5个neoTCR克隆型。在患者10体内,只发现了针对ACER3突变的两个neoTCR克隆型。在患者11体内,发现了针对5个基因突变的14个neoTCR克隆型。
Puig-Saus注意到,与对免疫治疗有反应的患者相比,这些对免疫治疗没反应的患者,不仅neoTCR克隆型少,而且在不同时间采集的血液和肿瘤样本也不经常出现。
此外,这四位患者neoTCR克隆型的功能分析发现,居然都对自体癌细胞系有毒性作用,而对非匹配的黑色素瘤细胞系没有毒性作用。
患者9的neoTCR克隆型在不同样本中随时间的变化
基于以上研究成果,Puig-Saus等认为,别看肿瘤中的突变那么多,实际上新抗原特异性的癌症免疫反应针对的只是数量有限突变(范围为3至13)。
不过,在对PD-1抑制剂有长期临床反应的患者中,新抗原特异性T细胞反应是多克隆的,即有多种新抗原特异性TCR克隆型针对同一个突变,而且在血液和肿瘤中都可以检测到这些新抗原特异性TCR克隆型。
因此,Puig-Saus等认为天然T细胞反应是通过不同的T细胞克隆型,靶向非常有限的突变来清除肿瘤的。这也为基于T细胞的免疫治疗,提供了新思路。
参考文献:
[1].Puig-Saus, C., Sennino, B., Peng, S. et al. Neoantigen-targeted CD8+ T cell responses with PD-1 blockade therapy. Nature, 2023. https://doi.org/10.1038/s41586-023-05787-1
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


