除了铁死亡/铜死亡,还有钠死亡:我国学者发现新型细胞死亡方式,并揭示其与心脏病的关联
来源:生物世界 2025-02-08 13:21
这项研究为受控钠离子内流介导的细胞坏死及其对疾病的影响提供了新见解。
钠离子内流和过载在人体组织损伤中经常被观察到,而钠过载是否会导致坏死性细胞死亡以及其中涉及的机制尚不清楚。
2025 年 2 月 6 日,上海交通大学医学院钟清团队与中国科学院上海药物所李扬团队合作,在 Nature 子刊 Nature Chemical Biology 上发表了题为:Persistent activation of TRPM4 Triggers necrotic cell death characterized by sodium overload 的研究论文。
该研究发现并定义了一种以钠过载为特征的坏死性细胞死亡新形式,并将其命名为——钠过载细胞坏死(Necrosis by Sodium Overload,NECSO)。

2023 年 4 月,钟清团队等发表论文,报道了一种小分子化合物——Necrocide1(NC1),其作为细胞坏死诱导剂,介导人类癌细胞的坏死性细胞死亡和免疫原性反应。更重要的是,其诱导的坏死性细胞死亡与坏死性凋亡、铁死亡、焦亡以及其他已知的细胞死亡通路不同。

在这项发表于 Nature Chemical Biology 的最新研究中,研究团队确认了 Necrocide1(NC1)通过钠离子过载(sodium overload)诱导细胞坏死性死亡,并将这种细胞死亡形式命名为——钠过载细胞坏死(Necrosis by Sodium Overload,NECSO)。
Necrocide1(NC1)作用于非选择性单价阳离子通道 TRPM4,从而促进钠离子内流和细胞坏死。TRPM4 缺陷细胞对 NC1 诱导的 NECSO 具有抗性。由于跨膜区存在差异,NC1 特异性激活人类的 TRPM4 而非小鼠的 TRPM4,这一点通过结构域交换和分子对接得以揭示。
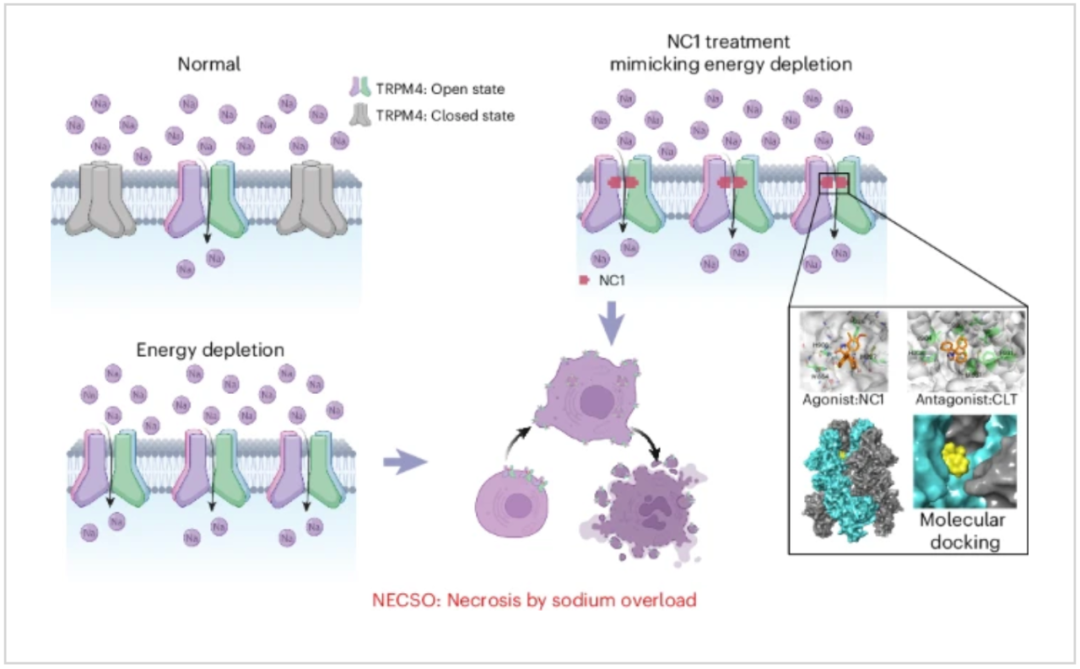
TRPM4 基因突变与心律失常有关,该研究发现,与心律失常有关的人类 TRPM4 功能增益(GOF)突变对由 NC1 或 2-脱氧-D-葡萄糖(2-DG,一种糖酵解抑制剂)触发的 NECSO 显示出更高的易感性,而 TRPM4 基因敲除的人类心肌细胞则对这两种情况更加耐受。这表明了 TRPM4 介导的 NECSO 可能在能量缺失诱发的心脏疾病中发挥重要作用。
此外,研究团队还通过化学筛选鉴定出了能抑制由 NC1 或能量耗竭诱导的细胞坏死的 NECSO 抑制剂——二氢吡啶类钙通道阻滞剂(DHP-CCB)和克霉唑(Clotrimazole)。总的来说,这项研究为受控钠离子内流介导的细胞坏死及其对疾病的影响提供了新见解。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


