胶质母细胞瘤最新研究进展
来源:生物谷原创 2022-08-30 10:55
胶质母细胞瘤是星形细胞肿瘤中恶性程度最高的胶质瘤。肿瘤位于皮质下,多数生长于幕上大脑半球各处。呈浸润性生长,常侵犯几个脑叶,并侵犯深部结构,还可经胼胝体波及对侧大脑半球。
胶质母细胞瘤是星形细胞肿瘤中恶性程度最高的胶质瘤。肿瘤位于皮质下,多数生长于幕上大脑半球各处。呈浸润性生长,常侵犯几个脑叶,并侵犯深部结构,还可经胼胝体波及对侧大脑半球。发生部位以额叶最多见。
就像最顽强的野草一样,胶质母细胞瘤几乎总是卷土重来---通常是在患者最初的脑瘤被手术切除后几个月内。这就是为什么这种癌症的存活率在一年内只有25%,在五年内骤降至5%。治疗这种疾病的挑战之一是,外科医生不能总是切除可能残留在大脑中的每一个肿瘤或胶质瘤干细胞。
生物谷小编梳理了一下近期生物谷报道的胶质母细胞瘤研究方面的新闻,供大家阅读。
1.Science子刊:重大进展!注射一种水凝胶有望治疗胶质母细胞瘤
doi:10.1126/scitranslmed.abn1128
美国威斯康星大学麦迪逊分校药学院药物科学部助理教授Quanyin Hu解释说,“胶质母细胞瘤的一个特点是,肿瘤细胞非常具有侵略性,它们会渗透到周围的组织中。所以外科医生不能清楚地感觉到肿瘤和正常组织之间的界限,而且你不能尽可能多地切除,因为大脑中的所有组织都非常重要---你当然不想切除太多。因此,这种肿瘤会再次复发,而这大大降低了治疗后的存活率。”
但是Hu实验室已开发出一种强大的免疫增强性术后治疗方法,可能改变胶质母细胞瘤患者的胜算。在一项新的研究中,Hu和他的合作者发表了他们关于该疗法在人类胶质母细胞瘤小鼠模型中的应用。相关研究结果发表在2022年8月3日的Science Translational Medicine期刊上,论文标题为“Intracavity generation of glioma stem cell–specific CAR macrophages primes locoregional immunity for postoperative glioblastoma therapy”。

Hu实验室开发了一种水凝胶,它可以被注射到切除肿瘤后留下的脑腔中。Hu指出,这种水凝胶给送方法效果很好,因为它完全填满了脑腔,缓慢地将它携带的纳米颗粒释放到周围组织中,并促进杀癌免疫反应。
这种水凝胶含有携带着编码嵌合抗原受体(CAR)的基因的纳米颗粒,这些纳米颗粒旨在进入某些类型的免疫细胞---称为巨噬细胞---并使它们表达可以靶向胶质瘤干细胞的CAR,由此产生的巨噬细胞称为CAR巨噬细胞(CAR macrophage, CAR-M)。这些免疫细胞通常会清理体内的传染性入侵者,但在肿瘤环境中,它们可能会转变为抑制免疫系统和促进癌症生长的形式。由于手术造成的炎症,这些叛变的巨噬细胞会涌向手术部位,可能会助长癌症复发。Hu说,“我们想利用这些巨噬细胞,把它们从敌人变成盟友。”
为了做到这一点,这些纳米颗粒进入这些巨噬细胞并使它们表达的CAR靶向一种叫做CD133的糖蛋白,这是胶质瘤干细胞的一种标志物。Hu及其研究团队还添加了一种CD47抗体,它能阻止“不要吃我”的信号,从而促进CAR-M细胞识别癌细胞。针对小鼠模型的临床前结果显示这种水凝胶治疗成功地产生了胶质瘤干细胞特异性的CAR-M细胞 ---本质上就是在现场对巨噬细胞进行重编程,使之靶向并杀死任何残留的胶质瘤干细胞。
2.Cancers:通过剥夺肿瘤细胞的糖分获取或有望帮助治疗人类多形性胶质母细胞瘤
doi:10.3390/cancers14164003
近日,一篇发表在国际杂志Cancers上题为“5-ALA Is a Potent Lactate Dehydrogenase Inhibitor but Not a Substrate: Implications for Cell Glycolysis and New Avenues in 5-ALA-Mediated Anticancer Action”的研究报告中,来自挪威奥斯陆大学医院等机构的科学家们通过研究发现,通过剥夺糖分或能帮助抵御机体的肿瘤。
多形性胶质母细胞瘤(GBM)的外科手术是通过利用荧光光敏剂(PS, fluorescent photosensitiser)药物来辅助治疗,这些药物通常用作光动力疗法(photodynamic therapy),其中的一种荧光光敏剂就是原卟啉IX(PpIX,Protoporphyrin IX),其是生化血红素循环中的外源性5-氨基乙酰丙酸(5-ALA)的元药物(metadrug),由于GBM肿瘤附近的结构和功能性差异,PpIX能精确地指导GBM的切除术,因为其原药5-ALA能非常特异性地在GBM肿瘤位点进行积累,这是目前GBM切除术的标准做法,且已经得到了FDA和欧洲药品管理局的批准,精确的肿瘤切除往往能大幅地增加患者的生存率。
研究人员发现,除了作为一种光敏药物外,5-ALA还能作为一种有效的糖酵解酶-乳酸脱氢酶(LDH)的潜在抑制剂,这是一项非常重要的研究发现,因为大部分肿瘤细胞都能从糖酵解或葡萄糖的分解过程中获取能量,而健康细胞则能通过呼吸作用获得能量。中断癌细胞中的糖酵解过程或能驱动癌细胞死亡,从而使其无法从其它来源满足其能量需求,这是癌症疗法中已经建立的一种成熟的疗法,而LDH则被认为能作为很多抗癌疗法的非常有价值的一个靶点。
5-ALA能作为LDH的抑制剂,同时也能作为糖酵解过程的抑制剂,其优势在于其能在GBM肿瘤中特异性地积累,这或许是正常细胞的几十倍;因此,GBM细胞中糖分分解过程的中断或许就会导致癌细胞死亡,这或许就有望帮助开发新型GBM疗法以及治疗其它类型癌症的潜在疗法。
3.Cell:重大进展!揭示胶质母细胞瘤伪装成未成熟的神经元在大脑中扩散
doi:10.1016/j.cell.2022.06.054
胶质母细胞瘤(GBM)是最具侵略性的脑瘤形式,它的某些细胞模拟未成熟神经元的特征和运动策略在大脑中定植。在一项新的研究中,来自德国癌症研究中心(DKFZ)、海德堡大学医院(UKHD)和海德堡医学院(MFHD)的研究人员首次提供了对GBM扩散机制的详细见解。
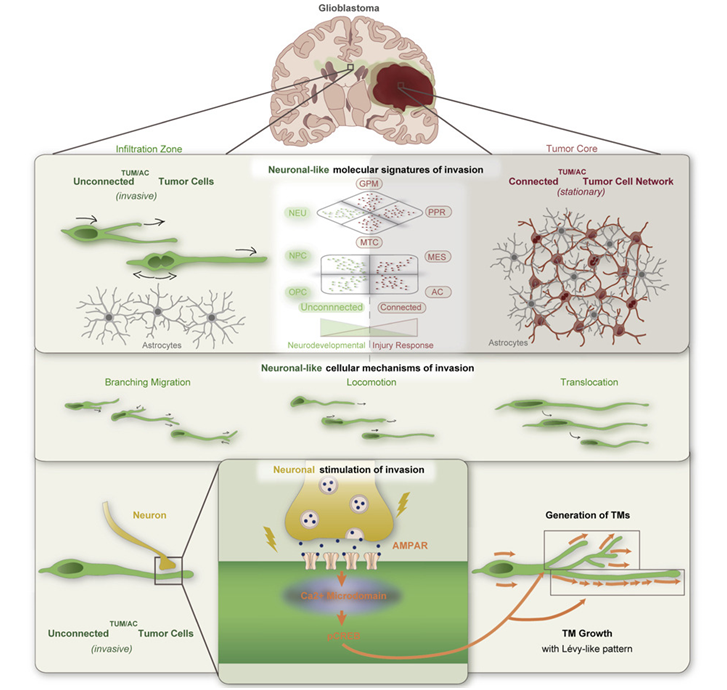
图片来自Cell, 2022, doi:10.1016/j.cell.2022.06.054。
GBM细胞在健康的脑组织中移动,在一个合适的地方停留下来,然后形成恶性网络,通过这些网络与“母肿瘤(mother tumor)”重新建立连接。这些入侵的GBM细胞不仅与神经细胞的前体细胞具有相同的分子特征,而且它们还以相同的运动模式迁移,并像这些细胞一样与大脑的健康神经细胞建立联系。相关研究结果于2022年7月31日在线发表在Cell期刊上,论文标题为“Glioblastoma hijacks neuronal mechanisms for brain invasion”。
4.PNAS: 在胶质母细胞瘤模型中,STING激活促进强大的免疫反应和NK细胞介导的肿瘤消退
doi:10.1073/pnas.2111003119
近日,来自德克萨斯大学西南医学中心的研究者们在PNAS杂志上发表了题为“STING activation promotes robust immune response and NK cell–mediated tumor regression in glioblastoma models”的文章,该研究揭示了通过激活GBM中的STING激活TME的治疗潜力和深刻的重塑,并值得进一步研究STING激动剂或与其他免疫疗法联合使用,如癌症疫苗、嵌合抗原受体T细胞、NK疗法和免疫检查点阻断。
在本研究中,研究者研究了STING通路在基底膜中的地位以及STING激动剂Adu-S100对脑肿瘤微环境(TME)的调节。该数据显示,在人的基底膜标本中存在刺痛,它在肿瘤血管中强烈染色。
研究者发现人的GBM外植体可以通过分泌炎性细胞因子对刺痛激动剂的治疗产生反应。在小鼠GBM模型中,结果显示在STING激动剂治疗后,肿瘤免疫格局发生了深刻的变化,携带肿瘤的大脑半球大量渗透天然免疫细胞,包括炎性巨噬细胞、中性粒细胞和自然杀伤(NK)群体。
用可生物降解的Adu-S100负载的颅内植入物治疗已建立的小鼠颅内GL261和CT-2A肿瘤表明,这两种模型的存活率和GL261免疫记忆的长期存活率都有显著提高。由于NK细胞耗尽,对治疗的反应消失。
5.Theranostics:新揭示!科学家揭示了胶质母细胞瘤化疗耐药的新机制
doi:10.7150/thno.71763
多形胶质母细胞瘤(GBM)是最常见的恶性原发性颅内肿瘤,在成人中死亡率高。GBM确诊后,目前可用的传统治疗方法包括安全的手术切除GBM肿瘤,然后结合放疗和化疗。替莫唑胺(TMZ)是一种口服烷化剂,常规用于治疗GBM。尽管TMZ在治疗的早期阶段对GBM显示出显著的治疗潜力,但超过40%的GBM患者逐渐对TMZ产生耐药性,导致病情恶化和死亡。目前,克服TMZ耐药性仍然是GBM治疗的主要挑战。因此,迫切需要寻找一种可靠的生物标志物来预测TMZ的疗效,并进一步探讨导致GBM患者TMZ耐药的潜在机制。
近日,来自天津医科大学总医院的研究者们在Theranostics杂志上发表了题为“PTRF/Cavin-1 enhances chemo-resistance and promotes temozolomide efflux through extracellular vesicles in glioblastoma”的文章,该研究强调PTRF可作为预测TMZ治疗后GBM患者预后的独立生物标志物,并描述了导致TMZ耐药的新机制。此外,该研究可能为GBM的治疗提供新的思路。
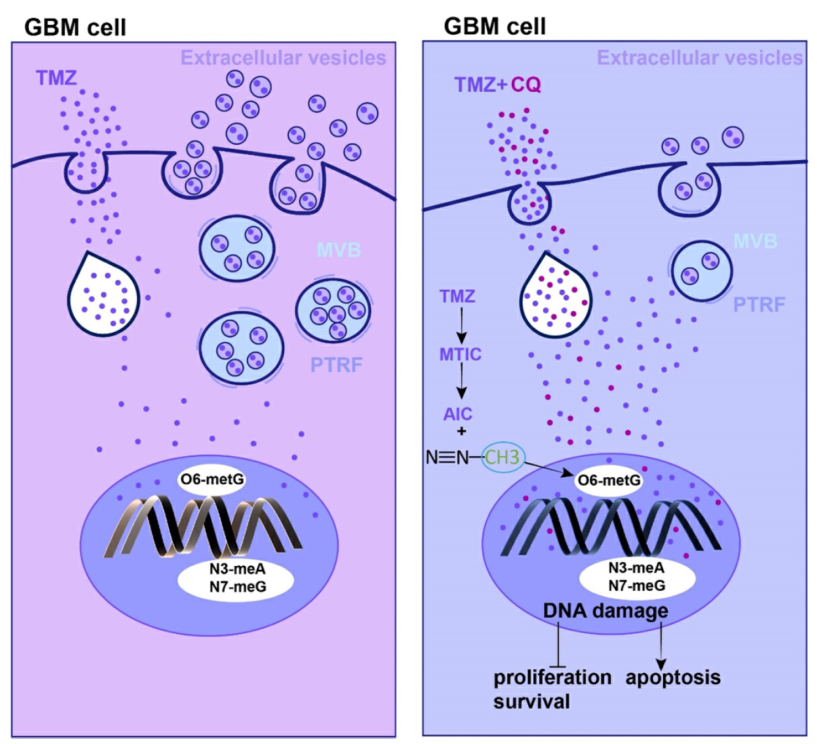
TMZ耐药机制及TMZ加CQ序贯治疗降低胶质母细胞瘤对TMZ耐药性的研究。图片来源: https://pubmed.ncbi.nlm.nih.gov/35673568/
研究者应用了TCGA数据分析、CGGA数据分析、透射电子显微镜、扫描电子显微镜、克隆形成、细胞计数试剂盒-8(CCK-8)、免疫印迹(WB)、免疫荧光(IF)、免疫组织化学(IHC)和流式细胞仪分析等方法,探讨PTRF在多种GBM细胞株和GBM患者来源的异种移植(PDX)模型中对TMZ耐药的机制和影响。
TMZ治疗GBM患者的预后与PTRF表达呈负相关。本研究结果显示,TMZ处理后,PTRF基因下调显着抑制了GBM的增殖,增加了细胞的凋亡率。此外,PTRF通过增加TMZ通过细胞外小泡(EVS)的外流而增加对TMZ的耐药性。此外,本结果表明,TMZ和CQ的序贯治疗通过增加TMZ的细胞内浓度,显著提高了TMZ抗GBM的疗效。
6.Theranostics:肿瘤相关巨噬细胞分泌的TGFβI促进胶质母细胞瘤干细胞驱动的肿瘤生长
doi:10.7150/thno.69605
在胶质母细胞瘤(GBM)微环境中,肿瘤相关巨噬细胞(TAMs)是促进肿瘤生长的重要成分。TAMS促进胶质瘤干细胞(GSCs)维持和肿瘤生长的确切分子机制在很大程度上仍不清楚。近日,华中科技大学的研究者们在Theranostics杂志上发表了题为“TGFBI secreted by tumor-associated macrophages promotes glioblastoma stem cell-driven tumor growth via integrin αvβ5-Src-Stat3 signaling”的文章,在本研究中,研究者发现了一种候选分子--转化生长因子-β诱导分子(TGFBI),该分子由TAMS特异表达,在GBM和GSC细胞中低表达,同时与胶质瘤WHO分级和患者预后密切相关。探讨了TGFBI将TAM功能与GSC驱动的肿瘤生长联系起来的确切机制。
研究者采用Western印迹、实时定量聚合酶链式反应(qRT-PCR)、酶联免疫吸附试验(EL ISA)、免疫荧光(IF)、免疫组织化学(IHC)和公开数据集等方法评价TGFBI在GBM中的来源和水平。体外检测GSCs对重组人TGFBI的反应,建立异种原位移植模型,研究GSCs在体内的作用和机制。
在高级别胶质瘤中,M2样TAMs的浸润率升高。TGFBI多由类M2的TAMs分泌,与GBM患者预后不良有关。TGFBI在体内外通过整合素αvβ5-src-STAT3信号通路促进GSC的维持和基底膜的恶性生长。具有临床意义的是,GBM患者血清和脑脊液中TGFBI含量显著升高,肿瘤切除后显著降低。
7.Science子刊:我国科学家领衔揭示利用新型纳米胶囊递送CRISPR-Cas9有望安全有效地治疗胶质母细胞瘤
doi:10.1126/sciadv.abm8011
在一项新的研究中,来自中国河南大学和澳大利亚麦考瑞大学等研究机构的研究人员开发出一种纳米胶囊,它能够穿越血脑屏障(BBB),携带CRISPR-Cas9编辑工具来治疗脑瘤。相关研究结果发表在2022年4月20日的Science Advances期刊上,论文标题为“Blood-brain barrier–penetrating single CRISPR-Cas9 nanocapsules for effective and safe glioblastoma gene therapy”。在这篇论文中,他们描述了他们如何创建他们的纳米胶囊,以及当在患有胶质母细胞瘤的小鼠身上进行测试时它的效果如何。
胶质母细胞瘤是众所周知的难治之症。这种肿瘤出现在大脑中,它的生长会破坏组织。治疗方案包括手术切除,直接注射旨在杀死癌细胞的药物,或者将携带CRISPR-Cas9的病毒注入到血液中。这些方案中的每一种都有缺点,比如脑组织受损,因药物难以穿越血脑屏障而导致的无效。在这项新的研究中,这些作者尝试了一种新方法:使用能够安全穿越血脑屏障的纳米胶囊将CRISPR-Cas9编辑工具携带到脑瘤中,在那里它靶向一个负责产生新细胞的基因。

Cas9/sgRNA纳米胶囊的制备、物理性质和细胞功能,图片来自Science Advances, 2022, doi:10.1126/sciadv.abm8011。
这种纳米胶囊的外壳是用一种二硫化物交联的聚合物制成的,然后用一种Angiopep-2肽进行点缀。添加该肽是为了产生中性的表面电荷,这样它就不会被核糖核酸酶攻击。这种纳米胶囊的外壳大到足以容纳CRISPR-Cas9复合物,但仍然足够小(大约30纳米长),使它能够通过血脑屏障。
这些作者在胶质母细胞瘤小鼠模型中测试了他们的纳米胶囊递送系统。每只小鼠都进行了一次尾部注射---一些小鼠接受了这种新开发的纳米胶囊递送系统,而另一些则接受了对照处理。他们发现,接受这种新疗法的小鼠的平均生存时间为68天,而对照组为24天。他们还发现在其他脑组织中,不希望发生的基因突变率不到0.5%。
8.Nature子刊:科学家发现M1-巨噬细胞外囊泡对胶质母细胞瘤的强协同治疗效果
doi:10.1038/s41392-022-00894-3
多形性胶质母细胞瘤(GBM)是危害性极高的脑肿瘤,其特征是预后不良、死亡率极高和复发倾向高。尽管在手术、放疗和化疗方面取得了进展,但GBM患者的中位生存时间仅为15-16个月,5年总生存率不到5%。因此,迫切需要开发治疗GBM的新的有效治疗方案。近日,深圳大学第一附属医院和中国科学院大学的研究学者在Signal Transduction and Targeted Therapy期刊上发表了一篇学术论文,题为“Exploration and functionalization of M1-macrophage extracellular vesicles for effective accumulation in glioblastoma and strong synergistic therapeutic effects”,在这项研究中,他们成功开发了M1样巨噬细胞衍生的细胞外囊泡(M1EV),发现M1EV在GBM中能有效积累,并具有强协同治疗效果。
研究人员从64例人胶质瘤患者中收集了肿瘤样本,按WHO分类,包括低级别胶质瘤(LGG:弥漫性星形细胞瘤,DA)和高级别胶质瘤(HGG:间变性星形细胞瘤,AA;GBM),利用免疫组化(IHC)用于定量肿瘤相关巨噬细胞(TAM),结果发现,GBM中富集M2巨噬细胞,且大多数浸润巨噬细胞来自外周血。因此,他们设想使用来自M1样巨噬细胞的EV作为一种策略,以促进通过血脑屏障(BBB)和免疫调节性抗胶质瘤治疗靶向药物递送到肿瘤。
为了最大限度地发挥协同效应,他们使用两种疏水剂(化学激发源CPPO(C)和光敏剂Ce6(C))进一步功能化了M1EV的膜,并将亲水性缺氧活化前体药物AQ4N(A)加载到M1EV的内核中。静脉注射后,M1衍生的细胞外囊泡CCA-M1EV的固有性质允许血脑屏障渗透,并通过M2至M1极化调节免疫抑制肿瘤微环境,从而增加过氧化氢(H2O2) 级别。此外,H之间的反应2O2CPPO产生化学能,可用于Ce6活化产生大量活性氧,实现化学激发光动力疗法(CDT)。由于这种反应消耗氧气,肿瘤缺氧的恶化也导致无毒AQ4N转化为有毒的AQ4进行化疗。因此,CCA-M1EV在GBM中实现了协同免疫调节,CDT和乏氧活化化疗,以发挥有效的治疗效果。最后,研究人员利用细胞来源的异种移植和患者来源的异种移植模型中证明了CCA-M1EV对GBM的出色效果,强调了该高度灵活的M1EV系统在支持难以治疗的GBM的多模式疗法方面的巨大潜力。
doi:10.1172/JCI142137
目前研究人员迫切需要开发出管理且治疗胶质母细胞瘤(GBM)的新方法。近日,一篇发表在国际杂志Journal of Clinical Investigation上题为“Arginine deprivation alters microglia polarity and synergises with radiation to eradicate non arginine auxotrophic glioblastoma tumors”的研究报告中,来自伦敦帝国理工学院等机构的科学家们通过研究开发了一种新型有效的疗法来治疗胶质母细胞瘤,即同时使用ADI-PEG20和脑部病灶放射性疗法,这种双重疗法或能完全消除研究中动物模型机体中的肿瘤。
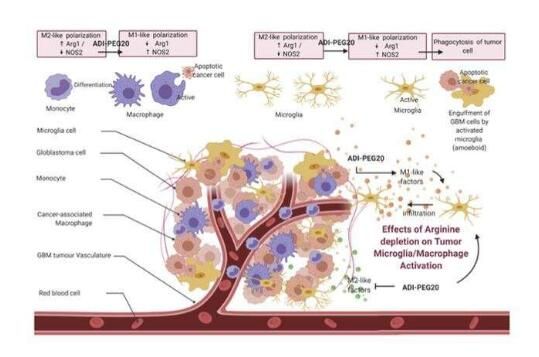
图解摘要。图片来源:DOI:10.1172/JCI142137
目前,胶质母细胞瘤是一种晚期疾病,患者的平均预期寿命不到两年时间,目前使用的方法是基于30多年前的疗法,因为如今科学家们在有效抵御这类肿瘤上并未取得太大的研究进展。本文研究中,研究人员提出了一种治疗胶质母细胞瘤的新型疗法,即将药物ADI-PEG20(一种能消除全身精氨酸的药物)与脑部病灶放射性疗法结合使用,基于这种新型疗法,研究人员或许就有望观察到迄今为止无法治愈的脑瘤是如何在体内模型中被完全消除的,而这些模型能发生自然死亡,且并不会表现出任何疾病的迹象。
研究者Sarmiento教授说道,通过这种新型组合性疗法,我们或许就有望治愈动物体内的侵袭性和终结性疾病;通过对死亡后动物机体的分析就能检测到其大脑的免疫反应,尤其是小胶质细胞如何在治疗期间被激活,从而引导其攻击肿瘤细胞并促进肿瘤的完全消除。研究人员所获得的数据时治疗这类肿瘤患者的一线希望,因为无论是新型抗癌药物如何成功,其在中枢神经系统中的疗效目前都是非常有限的,主要是因为其难以抵达大脑内部的癌细胞靶点处。
10.Cancer Cell Int:探索原发性和复发性胶质母细胞瘤中干细胞标记物
doi:10.1186/s12935-022-02510-4
胶质母细胞瘤(GB)是成人最常见、生长迅速、侵袭性极强的原发性脑肿瘤。标准的手术加辅助放化疗的治疗方法不能永久消除所有肿瘤细胞,且疗效有限,该类患者的中位总生存期小于2年。复发通常发生在多模式治疗中,治疗失败原因可能与癌症干细胞(CSCs)的存在有关,这是肿瘤细胞的一个亚群,与胚胎干细胞(ESCs)一样,这些高度恶性的细胞具有不断自我更新、增殖和分化的特征。CSCs负责肿瘤的起始、侵袭性生长和转移形成,从而影响肿瘤的形成和进展。
该实验共纳入30名患者(17名男性,13名女性)的60份组织样本,研究人员对来自胶质瘤患者的成对样本进行免疫组化分析,检测以下干细胞标记物的表达: CD133,Musashi,Nanog,Nestin,八聚体结合转录因子4 (Oct4)和性别决定区Y-box 2 (Sox2)。此外,研究骨桥蛋白(OPN)的表达。测定阳性染色细胞的相对数量。通过Kaplan-Meier分析,研究了标志物表达与总生存率的可能关联。
研究结果显示Nestin, Musashi和OPN的表达显著增加,CD133和Oct4也有增加(不显著)。异柠檬酸脱氢酶1/2 (IDH-1/2)突变的患者复发性肿瘤中CD133和Nestin的表达降低。原发性和复发性肿瘤的OPN和复发性肿瘤的Nestin之间的CD133和Nanog显著相关。通过共聚焦成像,可以证明复发性胶质瘤细胞中CD133和Nestin的共同表达。CD133高表达患者预后较差(22.6vs41.1个月,p=0.013)。Nestin水平升高也出现了类似的趋势(24.9个月比41.1个月,p=0.08)。
总之,大多数评估的标志物在复发肿瘤中表达增加,CD133和Nestin与生存相关,是进一步临床研究的候选标志物。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


