2021年11月HIV研究亮点进展
来源:本站原创 2021-11-30 23:59
2021年11月30日讯/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋
2021年11月30日讯/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
即将过去的11月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
1.Immunity:确诊后立即开始抗逆转录病毒治疗可降低HIV患者的癌症风险
doi:10.1016/j.immuni.2021.10.021
HIV感染者患皮肤癌和粘膜癌的风险增加,即使由于接受抗逆转录病毒治疗(ART),他们的血液中不再能检测到HIV病毒。在一项新的研究中,来自奥地利维也纳医科大学、路德维希-玻尔兹曼罕见与未诊断疾病研究所(LBI-RUD)和奥地利科学院CeMM分子医学研究中心的研究人员发现HIV感染者开始ART治疗的时间可以影响肿瘤产生。相关研究结果于2021年11月22日在线发表在Immunity期刊上,论文标题为“Delayed antiretroviral therapy in HIV-infected individuals leads to irreversible depletion of skin- and mucosa-resident memory T cells”。
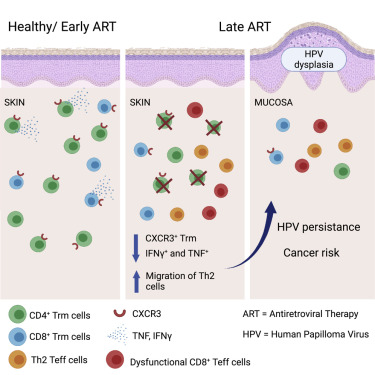
图片来自Immunity, 2021, doi:10.1016/j.immuni.2021.10.021。
也就是说,尽管经过多年的最佳ART治疗,HIV感染者仍然有更大的风险患上皮肤癌和粘膜癌。特别是,他们患那些由人类乳头瘤病毒(HPV)引起的癌症形式的风险更高。感染HIV的男性患HPV相关的肛门癌的风险比HIV阴性者高36倍之多。
2.eLife:揭示HIV对疗法产生耐受性及耐受性不断进化的分子机制
doi:10.7554/eLife.69032
20世纪80年代末,当HIV疗法被首次引入时,患者往往会在治疗的6个月内对疗法产生耐受性。20世纪90年代所引入的三重药物疗法就旨在改变这一情况,即使病毒会对其中一种疗法产生耐药性,但也会有另外两种药物能有效阻断其感染并改善患者的病情,这就实现了基本减轻HIV耐药性的问题,当然,在理论上是这样的,但很不幸的是,一些患者仍然会产生药物耐受性,这就给科学家们留下了一个问题,到底是为什么呢?
研究人员指出,时至今日,我们还有很多事情仍然并不明白,比如为何在使用三重药物疗法治疗HIV感染时,患者会产生耐受性?近日,一篇发表在国际杂志eLife上题为“Understanding patterns of HIV multi-drug resistance through models of temporal and spatial drug heterogeneity”的研究报告中,来自华盛顿大学等机构的科学家们通过研究就对上述问题进行了研究和解释。
通过利用两种计算机模型,研究者表示,这些观察结果或许是由于随着时间和整个机体的变化所产生的药物异质性所致,尽管患者同时接收三种HIV疗法,但药物往往有自己的半衰期,且患者并不总是会坚持疗法策略,这可能就会导致患者在真正接受其中一种药物治疗的情况下出现窗口期,从而导致药物耐受性的发生和进化。同时,药物也会不均匀地渗透到机体中,这就意味着在患者机体的某些部位,或许仅有一种药物能发挥有效作用,这就再次给病毒制造了机会产生对药物的耐受性和传播的风险。
3.Science子刊:解析出HIV病毒衣壳的三维结构,有助于开发出靶向HIV衣壳的抗病毒药物
doi:10.1126/sciadv.abj5715
在一项新的研究中,来自英国牛津大学、哈韦尔科学与创新园区和美国特拉华大学等研究机构的研究人员利用一种基于电子断层成像和子断层扫描图平均化(subtomogram averaging)的新技术,解析出HIV衣壳单独存在时和与宿主因子结合在一起时的结构。他们还利用从电子断层成像获得的信息建立了整个HIV衣壳的原子模型,他们认为这可能作为开发靶向HIV衣壳的抗病毒药物的蓝图。相关研究结果发表在2021年11月19日的Science Advances期刊上,论文标题为“Structure of native HIV-1 cores and their interactions with IP6 and CypA”。论文通讯作者为牛津大学结构生物学教授、钻石电子生物成像中心主任Peijun Zhang博士。
由于HIV-1病毒衣壳的亚稳定性,以适合高分辨率结构分析的数量和浓度分离完整的天然衣壳一直是个挑战;在用去污剂(一种传统的衣壳纯化方法)溶解膜后,衣壳会发生人为的解离。
Ni博士说,“为了解决这个问题,Zhang及其研究团队设计了一种新的方法。我们用一种穿孔毒素给HIV病毒样颗粒的膜打孔,而不是用去污剂提取,这避免了与病毒颗粒裂解和病毒核心(viral core)分离有关的损伤,但也可使病毒衣壳可以被外部细胞因子和小分子所接触。”
4.Ann Intern Med:发现第二例自然实现清除性治愈的HIV感染者
doi:10.7326/L21-0297
在感染期间,HIV将它的基因组整入到细胞的DNA中,形成所谓的病毒库。在这种状态下,这种病毒有效地躲避抗HIV药物和身体的免疫反应。在大多数感染者中,新的HIV病毒颗粒不断从这种病毒库中产生。抗逆转录病毒药物(ART)可以阻止新病毒的产生,但不能消除这种病毒库,因此必须每天进行ART药物治疗以抑制这种病毒。有些称为精英控制者(elite controller)的感染者具有能够抑制HIV的免疫系统,因而不需要ART药物治疗。虽然他们仍然携带这种病毒库,可以产生更多的HIV病毒,但一种被称为杀伤性T细胞的免疫细胞可以维持对这种病毒的抑制,而不需要ART药物治疗。
图片来自Pixabay/CC0 Public Domain。
如今,Yu团队报告了第二例未经治疗的称为埃斯佩兰萨患者(Esperanza Patient)的HIV感染者,与旧金山患者一样,在对埃斯佩兰萨患者的超过11.9亿个血细胞和5亿个组织细胞的基因组测序中没有发现完整的HIV基因组。这份报告可能代表了清除性治愈的第二个例子。相关研究结果于2021年11月16日在线发表在Annals of Internal Medicine期刊上,论文标题为“A Possible Sterilizing Cure of HIV-1 Infection Without Stem Cell Transplantation”。
5.PLoS Pathog:揭示HIV感染细胞表面上的糖分子在躲避免疫系统中起着重要作用
doi:10.1371/journal.ppat.1010034
在一项新的研究中,来自美国威斯塔研究所的研究人员发现受到HIV病毒感染的细胞(即HIV感染细胞)表面的关键特征如何帮助这种病毒逃避免疫系统的检测。它还显示了这些特征如何能够被禁用。这些发现是向一类新的治疗方法迈出的第一步,其目的不仅仅是抑制这种病毒的复制,而且还要杀死那些阻碍我们治愈HIV感染的持久性病毒携带细胞(即持久携带HIV的细胞)。相关研究结果于2021年11月11日发表在PLoS Pathogens期刊上,论文标题为“Siglec-9 defines and restrains a natural killer subpopulation highly cytotoxic to HIV-infected cells”。
在这项新的研究中,这些作者观察了HIV感染细胞表面上的一类叫做唾液酸的糖分子。这类糖分子与对抗疾病的“天然杀伤性”免疫细胞表面上的特殊受体(称为siglec)结合在一起。当被激活时,这些受体作为抑制剂,抑制这些杀伤性免疫细胞并使它们停止杀戮。Abdel-Mohsen说,“我们想,‘这些HIV感染细胞是否有可能利用这种相互作用--用这些糖类覆盖自己来逃避天然杀伤性免疫细胞的监视呢?’”
Abdel-Mohsen实验室发现情况确实如此,这些HIV感染细胞可以利用这种抑制性连接来逃避免疫监视。他们随后调查了他们是否能够操纵这种连接,使得杀伤性免疫细胞更有效地杀死HIV感染细胞。首先,他们研究了使杀伤性免疫细胞的抑制剂siglec失效是否会释放出它们的全部杀伤力。然而,这可能会导致杀伤性免疫细胞不分青红皂白地攻击,同时破坏健康和不健康的细胞。他们随后将注意力转向了HIV感染细胞。他们使用了一种叫做唾液酸酶(sialidase)的酶来去除激活免疫抑制剂siglec的唾液酸糖。然而,这再次影响了所有的细胞,导致杀伤性免疫细胞不分青红皂白地攻击。最后,他们开发了一种与HIV抗体相连的唾液酸酶偶联物。这种抗体-唾液酸酶偶联物只靶向HIV感染细胞表面上的唾液酸。随着这些HIV感染细胞表面上的唾液酸被清除,杀伤性免疫细胞攻击并杀死了它们,而不伤害健康细胞。
6.PLoS Biol:揭示HIV感染者快速衰老和慢性炎症的根源
doi:10.1371/journal.pbio.3001387
在一项针对HIV感染者的突破性研究中,来自加拿大阿尔伯塔大学的研究人员发现难以捉摸的称为中性粒细胞的白细胞在T细胞功能受损和数量下降以及与这种病毒相关的慢性炎症中发挥了作用。相关研究结果近期发表在PLoS Biology期刊上,论文标题为“Neutrophils promote T-cell activation through the regulated release of CD44-bound Galectin-9 from the cell surface during HIV infection”。
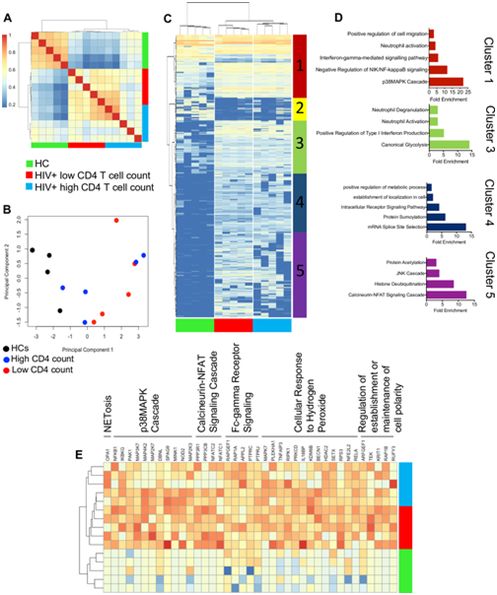
来自HIV感染者的中性粒细胞具有转录激活的表型。图片来自PLoS Biology, 2021, doi:10.1371/journal.pbio.3001387。
Elahi说,“我们发现并非所有HIV感染者都有类似的中性粒细胞类型。随着HIV疾病的进展,中性粒细胞变得更加活跃和更加有力,并反过来激活身体的T细胞,这很可能导致与HIV感染相关的一些问题,如炎症和快速老化。”
7.Brain Commun:揭示HIV患者出现慢性神经性疼痛的潜在大脑机制
doi:10.1093/braincomms/fcab260
远端感觉性多发性神经病(distal sensory polyneuropathy, DSP)是HIV感染中最普遍的神经系统问题,影响50%的HIV患者。大多数HIV-DSP患者描述他们的手或脚有麻木、刺痛、烧灼和刺痛的感觉,这损害了日常功能,并可能导致失业和抑郁。
以前对DSP的研究大多集中在周围神经系统,但神经损伤不能完全解释DSP症状的广泛差异性。在一项新的研究中,来自美国加州大学圣地亚哥分校和加州大学旧金山分校的研究人员转而研究了大脑,看看这如何促成患者的神经性疼痛。相关研究结果于2021年10月30日在线发表在Brain Communications期刊上,论文标题为“Association of painful human immunodeficiency virus distal sensory polyneuropathy with aberrant expectation of pain relief: functional magnetic resonance imaging evidence”。
这些作者观察到HIV-DSP患者在经历痛苦刺激时的独特大脑活动模式。与其他HIV患者相比,HIV-DSP患者显示出前脑岛(anterior insula)的活动增加,其中前脑岛是一个参与预测和情感上处理疼痛的大脑区域。
8.Nat Commun:口腔免疫功能障碍与HIV感染过程中FOXP3+PD-1+Amphiregulin+ T细胞的扩增有关
doi:10.1038/s41467-021-25340-w
尽管接受了联合抗逆转录病毒治疗(cART),HIV感染者仍然存在残余的全身性炎症和粘膜免疫功能障碍,但对其背后的免疫机制了解甚少。美国凯斯西储大学牙科医学院生物科学副教授Pushpa Pandiyan及其研究团队一直致力于探索这背后的免疫机制。
在一项新的研究中,Pandiyan团队发现正在服用抗逆转录病毒药物(防止HIV在体内扩散的药物)的HIV感染者的口腔功能障碍部分是由于免疫系统中通常会抑制炎症的调节性T细胞(Treg)出现功能失调。因此,Treg细胞没有减少炎症,并通过持续的功能障碍导致这些感染者变得更容易患上其他疾病(如牙周病)以及遭受可能的病毒和真菌感染。相关研究结果近期发表在Nature Communications期刊上,论文标题为“Oral immune dysfunction is associated with the expansion of FOXP3+PD-1+Amphiregulin+ T cells during HIV infection”。
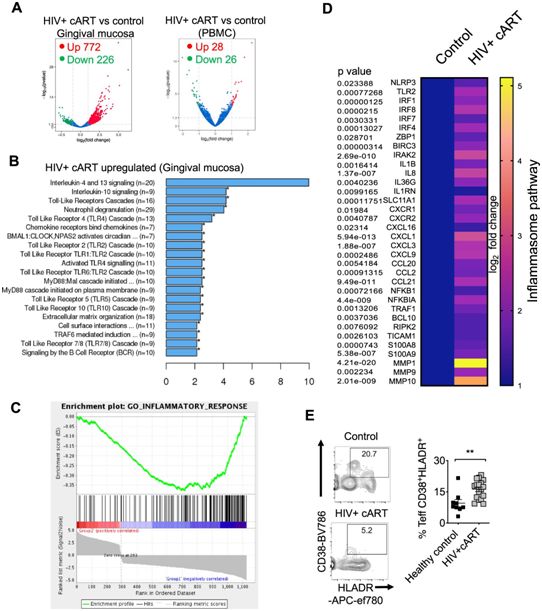
HIV阳性患者口腔黏膜的转录组分析和流式细胞术分析。46名接受cART治疗的HIV+患者和32名未感染的健康对照组被招募。图片来自Nature Communications, 2021, doi:10.1038/s41467-021-25340-w。
9.PNAS:科学家揭示早期HIV-1感染发生背后的分子机制
doi:10.1073/pnas.2102884118
许多病毒会直接参与并需要动力蛋白-动力蛋白激活蛋白马达适配复合体(dynein–dynactin motor–adaptor complex),以便沿着微管(MTs)运输到细胞核中并开始感染;HIV-1就能利用动力蛋白、动力蛋白适配体BICD2和核心动力蛋白激活蛋白亚单位;但与其它病毒却不一样,其并不需要动力蛋白激活蛋白-1(DCTN1),目前研究人员并不清楚HIV-1的变异的动力蛋白所参与的策略以及独立于DCTN1的背后的原因和分子机制。
近日,一篇发表在国际杂志PNAS上题为“Dynactin 1 negatively regulates HIV-1 infection by sequestering the host cofactor CLIP170”的研究报告中,来自美国西北大学等机构的科学家们通过研究发现,一种微管调节蛋白或能抑制早期HIV-1的感染。很多病毒都需要动力蛋白-动力蛋白激活蛋白马达适配复合体,该复合体主要负责沿着细胞骨架上的微管结构来将货物运输到细胞核中,而病毒则能利用这种复合体来抵达宿主细胞核并开始其感染之旅。
很多病毒能直接与微管运动蛋白结合从而在细胞中移动,但此前研究结果表明,HIV-1能利用一种不同的细胞机制来间接与马达适配复合体接触,此外,其也并不需要DCTN1蛋白,DCTN1是动力蛋白激活蛋白货物适配器的核心组分。通过分析被HIV-1感染的细胞,研究者Naghavi及其同事就发现,DCTN1能通过干扰病毒核心或病毒基因组周围核衣壳与宿主细胞内的关键辅因子(非蛋白化学物质)之间的相互作用的能力,来抑制早期的HIV-1感染。
具体而言,DCTN1能与细胞质连接蛋白170(CLIP170)竞争结合HIV-1颗粒,CLIP170是一种微管正端追踪蛋白(+TIP),此前研究人员已经证明了其在进入到宿主细胞之前能帮助调节病毒内核的稳定性。这篇研究报告中,研究者发现,DCTN1并不是作为一种动力蛋白激活蛋白复合体的组分来影响感染,而是作为+TIP,与CLIP170结合并阻断其与未进入的HIV-1颗粒发生相互作用。
10.Viruses:揭示小聚阴离子对逆转录病毒组装的影响
doi:10.3390/v13010129
逆转录病毒将其基因组副本插入其入侵的宿主细胞DNA中,从而改变该细胞的基因组的病毒。一旦进入宿主细胞的细胞质,这种病毒在逆转录过程中利用其逆转录酶(transcriptase)从其RNA基因组中产生DNA。然后,宿主细胞将病毒DNA视为其基因组的一部分,将病毒基因与细胞的基因一起转录和翻译,产生组装病毒新副本所需的蛋白。然后,新的DNA被一种整合酶(integrase)纳入宿主细胞的基因组中,此时的逆转录病毒DNA被称为前病毒(provirus)。
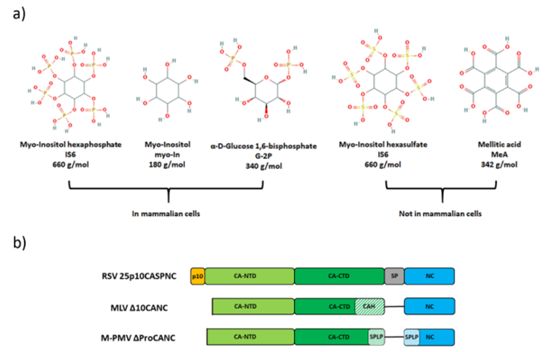
图片来自Viruses, 2021, doi:10.3390/v13010129。
数据显示,与连接CA-NC区段的某些结构相似性相反,只有一些逆转录病毒演化出一种使用小聚阴离子分子作为未成熟六聚体晶格的稳定剂的策略。虽然HIV-1以及很可能其他慢病毒的未成熟颗粒的组装以浓度依赖的方式被IP6稳定,在蛋白六聚体:IP6的比例为1:1时达到峰值,但发现α逆转录病毒和γ逆转录病毒RSV和MLV的成员的组装也分别被聚阴离子增强,但相互作用的模式仍然不清楚。
这些作者总结道,“我们的结果表明,RSV和MLV的未成熟颗粒的组装确实分别被肌醇六磷酸(myo-inostol hexaphosphate)和肌醇的存在所刺激。相反,没有观察到对作为β逆转录病毒成员的M-PMV组装的影响。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


