Nature子刊:癌细胞可以偷取免疫细胞的线粒体,提高癌细胞的侵袭性
来源:生物探索 2021-11-27 12:30
癌症,一直是当今社会面临的最严峻的问题之一,自从2018年癌症的免疫疗法获得诺贝尔奖以来,有关人体自身免疫对抗癌症的临床研究越来越多,但是收效并没有达到预期。造成这一问题的主要原因是免疫系统的作用机制还没有完全搞清楚,进而限制了免疫疗法的应用和发展。因此,研究并阐明癌细胞如何逃避免疫系统的“追杀”是寻找下一代癌症免疫疗法的关键一步。近
癌症,一直是当今社会面临的最严峻的问题之一,自从2018年癌症的免疫疗法获得诺贝尔奖以来,有关人体自身免疫对抗癌症的临床研究越来越多,但是收效并没有达到预期。造成这一问题的主要原因是免疫系统的作用机制还没有完全搞清楚,进而限制了免疫疗法的应用和发展。因此,研究并阐明癌细胞如何逃避免疫系统的“追杀”是寻找下一代癌症免疫疗法的关键一步。
近期,来自哈佛医学院的研究团队,在《Nature nanotechnology》发表了题为“Intercellularnanotubes mediate mitochondrial trafficking between cancer and immune cells”的文章,表述了癌细胞可以通过微/纳米管从免疫细胞中“偷走”线粒体并证明了纳米管介导的线粒体从免疫细胞向癌细胞的转移增强了癌细胞的代谢,提高了癌细胞侵袭性。
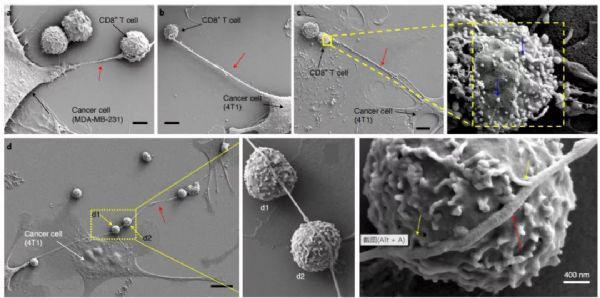
为了观察到癌细胞和免疫细胞之间的微管,研究者们将不同的小鼠和人类乳腺癌细胞与效应免疫细胞(NKT、CD3+/CD8+ )共培养,并使用场发射扫描电子显微镜(FESEM)检测共培养过程中的细胞间相互作用。结果显示,癌细胞和免疫细胞通过纳米管状结构物理连接,在某些情况下,来自癌细胞的单个纳米管与多个免疫细胞串联,并与免疫细胞膜形成多个接触。
在以往的研究中发现,这种微管/纳米管结构在调节细胞间通信、T细胞之间的艾滋病毒转移、神经元之间的朊病毒转移等方面都有作用。纳米管还可以在细胞间交易细胞器,比如线粒体的转移。线粒体功能对于免疫细胞的扩增、细胞因子的产生和有效的记忆反应至关重要,主要是因为线粒体中的ATP氧化磷酸化过程中提供的能量。对于癌细胞,线粒体可以提升癌细胞的能量供给,增加癌细胞扩增效率并提高化疗耐药性。
在本研究中,研究者们荧光标记了免疫细胞细胞中的线粒体,加入到未标记过的乳腺癌细胞中共培养16小时,发现乳腺癌细胞中观察到大量的斑点荧光,说明了线粒体从免疫细胞转移到癌细胞。再利用phalloidin红(一种染色剂)标记培养液中的纳米管,我们观察到荧光标记的线粒体在纳米管内的共定位,说明线粒体是通过纳米管传输的。
此外,研究者们用Hoechst染料标记DNA(细胞核和线粒体),观察到线粒体和DNA在纳米管中共定位,进一步验证了纳米管的线粒体运输,并且线粒体是完整无损的,并且研究者们也在小鼠模型中也发现了类似现象。
为了量化免疫细胞和癌细胞之间的线粒体转移,研究者们先用CellTrace Far Red (一种红色标记物)标记癌细胞,然后与标记线粒体(绿色)的T细胞共培养,然后使用流式细胞术量化示踪剂在细胞之间的转移。作为对照,研究者们在对照组设置了一层400纳米孔的膜隔开癌细胞和免疫细胞,可以允许分泌的信号分子和外泌体通过,但阻止通过物理纳米管的直接细胞通信。刚开始时,免疫细胞和癌细胞相对独立的存在两个区域,然而,培养16小时后,一个新的混合区域就产生了。在对照组(加膜组)没有这种现象,这就说明这种线粒体转移现象是通过微管进行的直接的物理对接而不是信号分子或者外泌体传递的信息。此外,研究者们还对不同的免疫细胞进行了相同的实验,发现它们都有相同的实验结果,说明线粒体通过微管在免疫细胞和癌细胞之间传递的现象是普遍存在的。
研究者们又测试了线粒体转移的指向性。实验表明,接收免疫细胞标记线粒体的癌细胞占总细胞的41.00%,而在反向培养中接收癌细胞标记线粒体的免疫细胞在共培养中只占总细胞的0.99%。因此,研究者们得出了结论:线粒体从免疫细胞向癌细胞的运输是单向的。
接下来,研究者们研究了线粒体转移对癌细胞代谢的影响。从共培养中分离出来的癌细胞比用膜隔开与免疫细胞共培养和单一培养的对照组癌细胞表现出更高代谢能力。
为了验证癌细胞的代谢增强是否由于从免疫细胞获得线粒体,在与癌细胞共培养前,使用抗霉素A和鱼藤酮或溴化乙啶破坏免疫细胞的线粒体,证实了癌细胞中的代谢增强是由于从免疫细胞中获得了线粒体。最后,研究者们又发现纳米管的形成与囊外复合物(sec3/sec5)密切相关,囊外复合物可以诱导细胞之间肌动蛋白重塑,进而形成微管。如果把Sec3或Sec5相关的基因敲除就可以大大减少免疫细胞和癌细胞之间的线粒体运输。
本次研究最终得出结论,纳米管介导的线粒体传输可能成为一种新的癌细胞逃避免疫的机制。虽然目前已批准的免疫治疗药物可以通过刺激免疫系统来激活免疫细胞,但如果免疫细胞的线粒体“被偷”,代谢受阻,一切都是白费了。因此,本研究的内容可以进一步启发新的免疫疗法。但是还有许多问题需要解决,比如,是什么驱动这些纳米管向特定细胞形成?是什么导致线粒体优先从免疫细胞向癌细胞移动?总的来说,免疫疗法是一个新兴的治疗手段,虽然已经有些临床成效,已经能够看到胜利的曙光,然而相关的机理探究还是任重而道远。不是我们不努力,实在是敌人太狡猾,不讲武德搞偷袭啊!(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。