Front Immunol:揭示CAR-Treg细胞有望用于解决移植耐受挑战
来源:本站原创 2021-11-22 13:56
美国南卡罗莱纳医科大学霍林斯癌症中心研究员Leonardo Ferreira博士因他在调节性T细胞(Treg)方面的开创性工作而备受瞩目。近期,他和他的合作者在Frontiers in Immunology期刊上发表了一篇标题为“Precision Engineering of an Anti-HLA-A2
2021年11月22日讯/生物谷BIOON/---美国南卡罗莱纳医科大学霍林斯癌症中心研究员Leonardo Ferreira博士因他在调节性T细胞(Treg)方面的开创性工作而备受瞩目。近期,他和他的合作者在Frontiers in Immunology期刊上发表了一篇标题为“Precision Engineering of an Anti-HLA-A2 Chimeric Antigen Receptor in Regulatory T Cells for Transplant Immune Tolerance”的论文,描述了他利用表达嵌合抗原受体(CAR)的Treg细胞(CAR-Treg)解决移植耐受挑战的经验。

Ferreira正通过利用Treg细胞的独特生物学特性,改变游戏规则。他的总体研究目标是更彻底地了解Treg细胞生物学特性,以便利用这类细胞来治疗一系列自身免疫疾病。
Ferreira解释说,“我在哈佛大学获得博士学位时开始对免疫系统充满热情。我的导师是Jack Strominger博士,他在20世纪80年代将HLA蛋白的结构结晶化。了解HLA在免疫学中非常重要,因为它是我们的身体如何识别我们自己的细胞和外来细胞或者说自我与非自我的主要‘钥匙’之一。”
在加州大学旧金山分校的博士后培训中,Ferreira将重点转向了对器官移植受者的免疫系统进行改造,以减少移植排斥反应。他说,“如今,很难为需要器官移植的患者找到匹配的供者。这是因为与HLA蛋白的匹配是一个主要障碍。人类有18种不同类型的HLA蛋白,这就是为什么有一个巨大的器官供者数据库,但与供者匹配的患者却如此之少。”
Ferreira认为免疫系统是一支军队。Treg细胞是“将军”,而其他免疫细胞是“士兵”。Treg细胞指导其他免疫细胞,当后者过度活跃时,如在自身免疫中,抑制它们,而当有威胁时,如感染或癌症,让它们充分发挥作用。
Ferreira说,“免疫系统参与了身体的每一项功能;它不是静止的。T细胞有‘X光’视力,通过眼罩只能看到它们应该攻击的其他细胞中的细胞内蛋白。”
在过去的五年里,他一直在优化CAR,以引导T细胞到达某些靶标。CAR取代了T细胞的正常表面受体,即T细胞受体(TCR)。Ferreira的研究涉及从人们身上提取免疫细胞并对其进行研究,他的目标是将Treg细胞作为“活药物”。
1型糖尿病是一种有用的模型,可用于确定CAR-Treg细胞是否具有治疗功能。CAR-Treg细胞经设计后前往胰腺并扑灭自身免疫的火焰。他说,截至今年,胰岛素作为1型糖尿病的治疗方法已经使用了100年,但它并没有治疗这种疾病的根源。免疫学可以通过阻止导致该疾病的慢性炎症而找到它的根源。
Ferreira说,这篇论文中描述的研究是首批使用一种名为CRISPR-Cas9的基因编辑方法精确设计CAR-Treg细胞的研究之一。这种方法就像用手术刀精确地去除Treg 细胞的原始TCR,然后在其位置上插入CAR。这种方法更安全,因为它确保只有一个CAR拷贝存在,并且CAR的调节方式与原始TCR相同。
具体而言,Ferreira及其团队描述了一种抗HLA-A2的CAR(A2-CAR),它是通过将人类单克隆抗HLA-A2抗体的互补性决定区域(CDR)嫁接到赫赛汀4D5单链可变片段的框架区域,并与CD28-ζ信号结构域融合而产生的。CDR嫁接的A2-CAR保持了原始抗体的特异性。
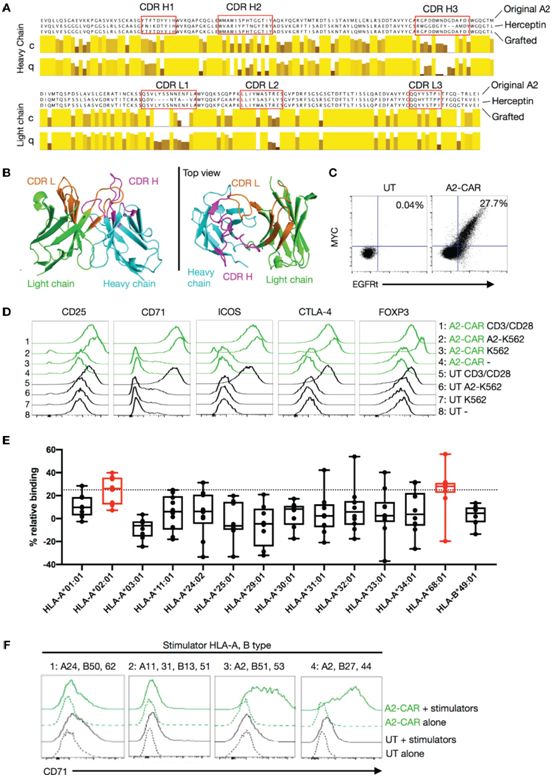
产生嫁接的A2-CAR,图片来自Frontiers in Immunology, 2021, doi:10.3389/fimmu.2021.686439。
然后,他们通过CRISPR/Cas9剔除人类Treg细胞的内源性TCR并使用慢病毒转导引入A2-CAR,或使用同源介导的修复(homology-directed repair, HDR)将CAR构造体直接整合到TCR α恒定位点,从而产生HLA-A2单特异性人类CAR-Treg细胞(A2-CAR-Treg)。这些缺乏TCR的人类A2-CAR-Treg细胞在体外保持Treg细胞的表型和功能。
此外,缺乏TCR的A2-CAR-Treg细胞有选择地在移植自HLA-A2转基因小鼠或已故人类供者的HLA-A2+胰岛(即表达HLA-A2的胰岛)中积累。它们没有损害这些HLA-A2+胰岛的功能,而类似的缺乏TCR的A2-CAR+ CD4+传统性T细胞在不到2周的时间内就排斥了HLA-A2+胰岛。缺乏TCR的A2-CAR-Treg细胞只有在存在由共同转移的外周血单核细胞或受者小鼠表达的HLA-A2的情况下才会延迟移植物抗宿主病。
Ferreira和他在加州大学旧金山分校的同事们使用一种带有人类胰岛细胞和人类免疫细胞的 “人源化”糖尿病小鼠模型,发现CAR-Treg细胞可以延迟或减少破坏性的炎症。他说,Treg细胞的丰富生物学特性如今刚刚被探索出来,使用CAR可能提供具有特异性的人工耐受。这些结果证实了经过基因组改造的单抗原特异性A2-CAR-Treg细胞定位到表达HLA-A2的移植物上,并表现出抗原依赖性的体内抑制作用,与TCR的表达无关。这种方法可用于开发精确的Treg细胞疗法,以实现移植耐受。
Ferreira如今正在他在南卡罗莱纳医科大学霍林斯癌症中心的实验室进行研究,以更全面地优化和理解CAR-Treg细胞的生物学特性。
在CAR-Treg细胞成为活药物之前,还有一些转化方面的挑战必须克服,如成本和批准。一个生物学上的障碍是,Treg细胞只占白细胞的大约1%~2%,因此获得足够的细胞用于治疗是一个挑战。
Ferreira认为,将基础科学和转化研究项目结合起来进行是很重要的,因为这些结果为这两个领域的研究提供了信息。
Ferreira说,“我对使用南卡罗莱纳医科大学这里的清洁细胞设施感到兴奋。我有一个装满不同CAR的车库,并渴望研究它们如何工作。有CAR-Treg细胞有可能被用于对抗癌症,而霍林斯癌症中心是与癌症研究人员合作的完美场所。”
他对霍林斯癌症中心的免疫学项目的愿景是帮助这个癌症中心继续扩大它的细胞疗法,并成为使患者更容易获得这种疗法的一部分。他说,“这里的研究人员之间有一种强大的互动动力。较小的教师规模与合作氛围、转化资源和cGMP洁净细胞设施相结合,使之成为南卡罗莱纳医科大学这个伟大研究团体的一部分,这是一个令人兴奋的时刻。”(生物谷 Bioon.com)
参考资料:
Yannick D. Muller et al. Precision Engineering of an Anti-HLA-A2 Chimeric Antigen Receptor in Regulatory T Cells for Transplant Immune Tolerance. Frontiers in Immunology, 2021, doi:10.3389/fimmu.2021.686439.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



