《自然》子刊:为什么山西人更容易患食管癌?
来源:奇点糕 2021-11-17 08:28
食管癌在全球范围内是第六大癌症死亡原因,其中食管鳞状细胞癌(ESCC)是最常见的亚型[1]。ESCC在不同地区的发病率有很大的差异,总体上高收入国家的发病率要远低于低收入国家[2],我国山西省就是高发病率地区。尽管许多的流行病学研究已经发现一些生活习惯(吸烟、饮酒)和环境因素(空气污染)是ESCC的风险因素,但这无法完全解释在全球不同地区之间存在
食管癌在全球范围内是第六大癌症死亡原因,其中食管鳞状细胞癌(ESCC)是最常见的亚型[1]。ESCC在不同地区的发病率有很大的差异,总体上高收入国家的发病率要远低于低收入国家[2],我国山西省就是高发病率地区。
尽管许多的流行病学研究已经发现一些生活习惯(吸烟、饮酒)和环境因素(空气污染)是ESCC的风险因素,但这无法完全解释在全球不同地区之间存在的发病率差异,科学家们猜测存在一种未知的外部风险因素在起作用[3]。
为了弄清楚这种外部因素的真面目,近日,由英国桑格研究所的Michael R. Stratton领衔的研究团队在《自然·遗传学》期刊发表重要研究成果[4]。
他们对来自不同发病率地区的552个ESCC病例进行了全基因组分析和癌症流行病学研究,发现这些病例的基因组突变谱是相似的,并且没有突变特征证据可以支撑存在一种未知外部因素能影响发病率的理论。不过他们却有另外的发现——APOBEC(载脂蛋白B mRNA催化样多肽)的激活是ESCC发展过程中的关键(科学发现有的时候就是柳暗花明又一村)。
ESCC相关的流行病学研究已经发现了一些地区特异的生活习惯和环境风险因素。例如吸烟和饮酒是低发病率地区的主要风险因素,并且往往是以协同作用的方式使得ESCC患病风险升高;而在伊朗这样的高发病率地区,吸食鸦片则是主要的风险因素。
外源性风险因素和内源性生物学过程都会诱导基因组出现独特的突变特征[5]。但目前已经发现的ESCC外源性风险因素仍然不足以解释地区间的发病率差异。
根据Michael R. Stratton团队的设想,如果存在一种未知的能诱导基因组突变的外部因素影响了不同地区的ESCC发病率,那么对不同地区病例的基因组突变特征进行比较就可找出与地区病例特异的突变特征有关的外部风险因素。
而之前关于ESCC的研究要么只描述了外显子的突变特征,要么就是只研究了高发病率地区的病例,这显然不够全面。
因此Michael R. Stratton团队选择了8个国家的552个ESCC病例,包括了5个高发病率地区(伊朗格勒斯坦(178例)、肯尼亚(68例)、坦桑尼亚(35例)、马拉维(59例)、中国山西(138例))和三个低发病率地区(巴西(30例)、日本(37例)、英国(7例)),并对他们进行了全基因组测序。结果显示这些患者的单碱基替换(SBS)突变、双碱基替换、插入缺失突变负荷分别为1191~62240/MB、2~260/MB、27~64358/MB不等。
随后研究人员利用两个不同的工具SigProfilerExtractor和HDP,从SBS突变中提取了20个新生突变特征,并利用COSMIC的突变特征(有已知的诱变因素)对它们进行了分解,以此解释其最可能相关的诱变因素。
在这个过程中,他们并没有发现能解释很大比例的突变负荷的未知外源性诱变因素。不过,有超过80%的ESCC突变负荷可以归类为6个COSMIC突变特征(SBS1、SBS2、SBS5、SBS13、SBS18、SBS40),其中SBS2和SBS13被认为是由于APOBEC家族激活而产生的一类突变,这两种突变特征分别出现在88%和91%的病例中,并且占了总突变负荷的25%。
上面这些是552个ESCC病例总体上的基因组特征,研究人员接着对比了不同地区病例的基因组突变谱,发现他们在一些主要的突变特征所占的比例上非常相似,只有一些特定的突变特征有地区间的差异(或许与生活习惯有关),而这些有差异的突变特征也大部分有已知的诱变因素(例如差异较大的SBS16与饮酒有关)。
对于这种和地区间发病率的差异不符的基因组特征,研究人员认为有可能是ESCC高发病率地区特异的基因组突变特征中包含有一些未知的组分,这些组分所能解释突变负荷也相对较少,导致没有办法解释。
既然未知外因找不到,就只能看看已知外因传递到细胞内部会在ESCC的关键基因上造成什么影响了。
研究人员利用同义突变和非同义突变在基因上观察到的数量与理论上会出现的数量的比值,识别了38个关键基因以及对应的1520个关键突变,这里面包括了一些已知的ESCC驱动基因(TP53、CDKN2A等)。
这其中,TP53是突变率最高的(500个病例携带),于是研究人员利用发生在TP53上的465个SBS突变构建了所有病例的TP53相关突变频谱,然而这个频谱的特征与前面提到的在所有病例中占主导的突变特征SBS2和SBS13差异很大,但是如果利用识别到的所有SBS关键突变构建突变频谱,则可观察到两者的相似之处,看起来APOBEC诱导的突变并不是发生在TP53上。
到这里,研究人员认为APOBEC的激活是ESCC发展过程中重要的一步,于是他们想知道APOBEC诱导的突变是否发生于肿瘤早期阶段,然而在比较了突变等位基因频率后发现,SBS2的C>T以及SBS13的C>G与其他突变在等位基因频率上并没有区别,说明不能证明APOBEC诱导的突变是否发生于肿瘤早期阶段。
最后,Michael R. Stratton团队分析了他们发现的ESCC突变特征与已知外部风险因素的关联和生殖细胞突变对ESCC的影响。
他们重现了许多以前报道过的突变特征和外部因素的关系,例如DBS2和ID3与吸烟相关,也发现了之前没有被报道的关系,例如在他们的数据中ID11与饮酒有关。
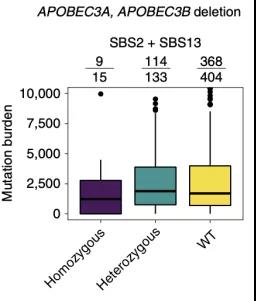
在生殖细胞变异分析中,他们发现了一个在APOBEC3区域的缺失型变异,它能显着降低APOBEC相关的突变负荷,这与之前报道的研究结论刚好相反,并且这个变异的理论频率要低于在东亚ESCC病例中观察到的频率,也进一步证明了APOBEC在ESCC发展中的重要作用[6]。
而其他的生殖细胞变异的影响在以前的研究中都有报道过,例如rs671会降低ALDH2的活性,导致携带者更容易因为饮酒过多而患上ESCC。
总的来讲,这项研究囊括了ESCC发病率不同的地区的病例,并且分析了他们的全基因组测序数据,更加全面的概括了ESCC的基因组特征。但也体现出肿瘤突变特征分析在发现相关的环境风险中的局限性,因为尽管不同地区的ESCC病例基因组突变特征相似却仍然不能排除存在未知的能影响发病率的环境风险因素。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


