Cell:新研究揭示垃圾DNA在哺乳动物发育中起着至关重要的作用
来源:本站原创 2021-10-31 23:37
2021年10月31日讯/生物谷BIOON/---我们近一半的DNA已经被视为垃圾,是进化的弃物:边缘化或破损的基因,整入在我们基因组中被肢解或沉默的病毒,它们都与人类机体或人类进化无关。但是过去十年的研究已表明,这些DNA “暗物质”(即垃圾DNA)中的一些确实有其功能,主要是调节编码蛋白的宿主基因---仅占我们总基因组的2%---的表达。然而,生物学家们
2021年10月31日讯/生物谷BIOON/---我们近一半的DNA已经被视为垃圾,是进化的弃物:边缘化或破损的基因,整入在我们基因组中被肢解或沉默的病毒,它们都与人类机体或人类进化无关。
但是过去十年的研究已表明,这些DNA “暗物质”(即垃圾DNA)中的一些确实有其功能,主要是调节编码蛋白的宿主基因---仅占我们总基因组的2%---的表达。然而,生物学家们仍在争论,这些垃圾DNA的调控序列是否在身体中发挥重要或有害的作用,还是仅仅是偶然的,是有机体不需要也能生存的意外。
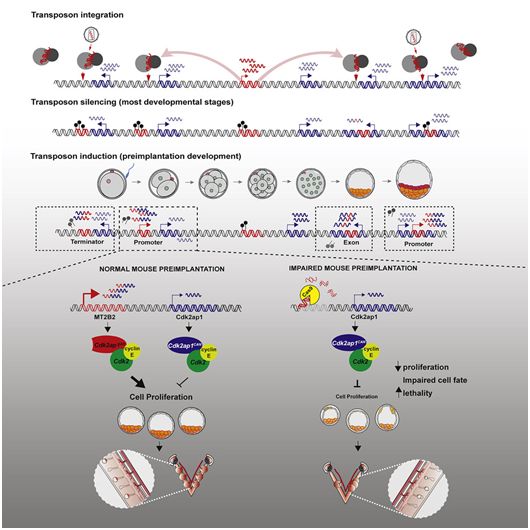
在一项新的研究中,来自美国加州大学伯克利分校和华盛顿大学的研究人员探索了这种垃圾DNA的一个组成部分--转座子---的功能,其中转座子是能够入侵其宿主基因组的自私DNA序列。该研究显示,至少有一个转座子家族--一种入侵我们基因组的古老病毒,在小鼠的生存能力中起着关键作用,也许在所有哺乳动物中也是如此。当他们在小鼠中敲除一个特定的转座子时,一半的小鼠幼崽在出生前就死亡了。这是第一个表明 “垃圾DNA”对哺乳动物生存至关重要的例子。相关研究结果发表在2021年10月28日的Cell期刊上,论文标题为“A mouse-specific retrotransposon drives a conserved Cdk2ap1 isoform essential for development”。

在小鼠中,这种转座子调节早期受精胚胎中细胞的增殖和在母体子宫中植入的时间。这些作者在包括人类在内的其他七种哺乳动物物种中进行了研究,也发现了与细胞增殖和胚胎植入时间有关的病毒衍生性调控元件,这表明古老的病毒DNA已被独立驯化,在所有哺乳动物的早期胚胎发育中发挥了关键作用。
根据论文共同通讯作者、加州大学伯克利分校分子与细胞生物学教授Lin He的说法,这些发现突出了一种经常被忽视的进化驱动因素:病毒整合到我们的基因组中并被重新用作宿主基因的调节者,开启了以前没有的进化选择。
He说,“小鼠和人类在其基因组中共享99%的蛋白编码基因---我们彼此之间非常相似。那么,是什么构成了小鼠和人类之间的差异?其中一个主要的差异是基因调控---小鼠和人类有相同的基因,但它们的调控方式不同。转座子有能力产生大量的基因调控多样性,可以帮助我们了解世界上物种特异性的差异。”
论文共同通讯作者、华盛顿大学圣路易斯医学院遗传学系医学教授Ting Wang对此表示同意。Wang说,“这个故事的真正意义在于它告诉我们进化是如何以最意想不到的方式进行的。转座子长期以来被认为是无用的遗传物质,但它们在哺乳动物的基因组中占了如此大的比重。很多有趣的研究说明,转座子是人类基因组进化的驱动力。然而,这是我所知道的第一个例子,即剔除一段垃圾DNA会导致一种致命的表型,表明特定转座子的功能可能是至关重要的。”
这一发现可能对人类不孕不育产生影响。根据论文共同第一作者、加州大学伯克利分校博士后研究员Andrew Modzelewski说,在人类所有的流产中,有近一半没有得到诊断,或者没有明确的遗传成分。像这样的转座子会不会参与其中?
他说,“如果我们的基因组有50%是非编码的或重复的--基因组暗物质--那么就非常诱人地提出这样的问题:人类的生殖和人类不孕的原因是否可以用垃圾DNA序列来解释。”
胚胎植入
He研究我们基因组中98%或更多不编码蛋白的DNA序列。在He的大部分职业生涯中,她一直专注于microRNA和更长的非编码RNA片段,这两者都是强有力的基因调节者。然而,五年前,她的团队意外地发现了一个名为MERVL(小鼠内源性逆转录病毒元素)的转座子家族的microRNA调节者,它参与了早期小鼠胚胎细胞命运的决定。小鼠胚胎中意外出现的大量转座子转录导致He的团队开始研究转座子的发育功能,其中转座子已经在地球上几乎所有生物的基因组中占据了一席之地。
在这篇论文中,He和她的团队确定了所涉及的关键调节DNA:一种转座子的片段,即病毒启动子--被重新用作一个小鼠基因的启动子,该基因产生的一种蛋白参与发育中的胚胎的细胞增殖和胚胎植入的时间。启动子是一段较短的DNA序列,需要位于一个基因的上游,以便该基因被转录和表达。
野生小鼠使用这种称为MT2B2的转座子启动子,专门在早期胚胎中启动基因Cdk2ap1的转录,以产生一种短蛋白“异构体”(下称短异构体),增加受精胚胎的细胞增殖,并加速其在子宫内的植入。通过使用CRISPR-EZ技术,即Modzelewski和He几年前开发的一种简单而廉价的技术,他们让MT2B2启动子失去功能,并发现小鼠从其默认启动子上表达Cdk2ap1基因,作为一种较长形式的蛋白异构体(下称长异构体),具有相反的效果:细胞增殖减少和延迟植入。敲除这种启动子的结果就是大约一半的小鼠幼崽在出生时死亡。
Modzelewski说,这种短异构体似乎能使小鼠的许多胚胎在子宫内以规则的间距植入,防止拥挤。当MT2B2启动子被敲除而仅使长异构体存在时,胚胎的植入似乎是随机的,其中的一些植入在子宫颈上,这阻碍了发育完全的胎儿的排出,有时在分娩过程中会杀死母体。
他们发现,在胚胎植入前的24小时内,MT2B2启动子加速了Cdk2ap1基因的表达,以至于这种短异构体占到了胚胎中存在的这两种异构体的95%。这种长异构体通常会在妊娠后期产生,这时Cdk2ap1基因上游的默认启动子变得活跃。
通过与论文共同第一作者、华盛顿大学Wang课题组的博士后研究员Shao Wanqing合作,这些作者搜索了八种哺乳动物物种---人类、恒河猴、狨猴、小鼠、山羊、牛、猪和负鼠---的植入前胚胎的公开数据,看看转座子是否在其他物种的植入前短暂开启。这些在线数据来自一种称为单细胞RNA测序(scRNA-seq)的技术,它记录了单细胞中mRNA的水平,这是哪些基因开启和转录的标志。在所有情况下,他们不得不检索非编码DNA的数据,因为它通常在分析前被移除,并假定它是不重要的。
虽然转座子通常是单个物种所特有的--比如,人类和小鼠的转座子集基本不同---但是,这些作者发现,在所有八种哺乳动物中,不同物种特有的转座子家族在植入前都会短暂开启,包括负鼠,这是该组中唯一不使用胎盘将胚胎植入子宫的哺乳动物。
He说,“令人惊讶的是,不同物种在植入前的胚胎中表达的转座子基本不同,但是这些转座子的全局表达谱在所有哺乳动物物种中几乎是相同的。”
论文共同通讯作者、前加州大学伯克利分校博士后研究员Davide Risso开发了一种将特定转座子与植入前基因联系起来的方法,以便剔除基因组中存在的数千个相关转座子的拷贝。这种方法对于识别具有重要基因调控活性的转座子元件至关重要。
图片来自Cell, 2021, doi:10.1016/j.cell.2021.09.021。
Risso说,“有趣的是,我们使用的数据大多是基于以前的称为SMART-seq的测序技术,它涵盖了RNA分子的全部序列。目前流行的技术,即10x基因组学技术,不会向我们展示不同层次的蛋白异构体。这种技术对其视而不见。”
病毒是进化的宝库
这些作者发现,在几乎所有的八种哺乳动物物种中,Cdk2ap1的短异构体和长异构体都会出现,但在不同的时间和不同的比例下开启表达,这与胚胎是早期植入(比如小鼠)还是晚期植入((比如牛和猪)有关。因此,在蛋白水平上,短异构体和长异构体似乎都是保守的,但它们的表达模式是物种特异性的。
Modzelewski说,“如果体内有大量的Cdk2ap1短异构体,比如小鼠,就会很早植入,而在牛和猪这样的物种中,没有或只有很少的短异构体,植入需要两个星期或更长时间。”
Wang猜测产生这种长异构体的默认启动子可能是小鼠的原始启动子,但是很久以前整合到基因组中的一种病毒后来被调整为调节元件,以产生短异构体和相反的效果。
他说,“因此,这里发生的是一种啮齿动物特异性病毒进入,然后宿主决定,‘好,我要用你作为我的启动子来表达这种更短的Cdk2ap1亚型。’我们看到这种系统内建的冗余,我们可以利用自然抛给我们的任何东西,使它有用。然后,这种新的启动子恰好比旧的更强。我认为这从根本上改变了啮齿动物的表型;也许这就是让它们长得更快的原因:植入前的时间更短。所以,它们可能从这种病毒中获得了一些健康益处。”
Wang补充说,“无论你在生物学中研究什么,你都会看到转座子被使用,仅仅是因为有这么多的序列。它们本质上为选择提供了一个进化库,供其发挥作用。”(生物谷 Bioon.com)
参考资料:
Andrew J. Modzelewski et al. A mouse-specific retrotransposon drives a conserved Cdk2ap1 isoform essential for development. Cell, 2021, doi:10.1016/j.cell.2021.09.021.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



