通过肾脏去神经支配靶向线粒体炎症循环可降低动脉粥样硬化和动脉粥样硬化的内皮表型
来源:本站原创 2021-10-14 14:50
内皮细胞线粒体氧化还原稳态的破坏可导致慢性炎症,这是动脉粥样硬化发展的重要因素。
内皮细胞线粒体氧化还原稳态的破坏可导致慢性炎症,这是动脉粥样硬化发展的重要因素。慢性交感神经过度活跃可增强氧化应激,引起内皮功能障碍。作者确定了肾去神经支配 (RDN),这种降低交感神经张力的策略,是否可以通过改善线粒体活性氧 (ROS) 诱导的炎症来减少动脉粥样硬化来保护 ECs。
图片来源:https://doi.org/10.1016/j.redox.2021.102156
动脉粥样硬化是冠状动脉疾病(CAD)的主要病理,是世界范围内的主要死亡原因。多种共病,如高血压、糖尿病、肥胖和衰老已被确定为动脉粥样硬化的危险因素。血管内皮功能障碍被认为是动脉粥样硬化发展的第一步,其特征是内皮功能表型的不适应改变。
线粒体是活细胞中活性氧(ROS)的主要来源,也是ROS诱导损伤的主要靶点。虽然线粒体功能障碍是多种疾病共同的致病机制,但线粒体特别是内皮细胞(ECs)在动脉粥样硬化发展中的作用尚未得到充分研究。线粒体氧化还原稳态的破坏是触发炎症和刺激先天免疫信号级联的关键因素,导致内皮激活和功能障碍。降低或中和线粒体ROS水平的策略可能通过减轻炎症反应、促进内皮修复和抑制动脉粥样硬化具有广泛的有益作用。
最近,许多研究表明内皮功能障碍常与交感神经系统过度活跃有关。有报告显示,动脉受神经支配,神经递质可能会影响炎症性白细胞与 ECs 的粘附,表明 SNS 也是参与动脉粥样硬化的一个因素。然而,交感神经过度活跃、氧化应激和炎症之间的关系尚不清楚。
单胺氧化酶a (MAO-A)是一种线粒体酶,负责交感神经递质去甲肾上腺素的代谢,并产生过氧化氢(H2O2)作为该酶反应的副产物。有趣的是,MAO-A的激活与交感冲动增加和去甲肾上腺素溢出升高有关。在此过程中,H2O2的过量生成导致线粒体氧化损伤,从而在动脉粥样硬化病理中造成血管损伤。p53是MAO-A/H2O2轴的主要效应体之一,并作为过氧化物酶体增殖物激活受体-γ共激活物-1α (PGC-1α)的抑制因子,PGC-1α是连接代谢调节、氧化还原控制和炎症通路的重要节点。这些观察结果以及 MAO-A 富含内皮的事实表明,在慢性交感神经过度活跃的情况下,MAO-A/H2O2 轴的持续激活可以驱动 ECs 中线粒体 ROS 诱导的炎症反应。
肾去神经支配通过切除肾动脉外膜的交感神经,可有效地降低全身交感神经活动。它已成为临床治疗难治性高血压的一种新方法。此外,RDN对胰岛素抵抗、氧化应激和炎症等内皮功能障碍的危险因素具有潜在的治疗作用。作者之前的研究表明,RDN可改善糖尿病患者的内皮功能。在这里,我们开始确定RDN是否可以通过改善内皮功能,特别是通过与mao - a诱导的线粒体ROS释放和内皮细胞炎症相关的恶性循环机制,来降低动脉粥样硬化。
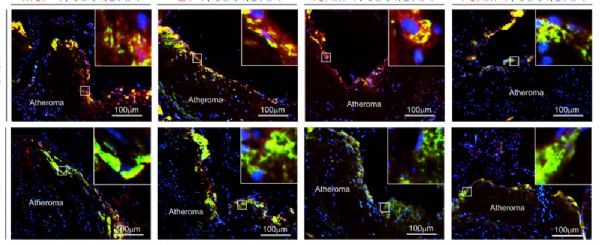
RDN改善高脂饲料喂养的载脂蛋白E敲除小鼠的动脉粥样硬化内皮细胞表型和炎症反应。
图片来源:https://doi.org/10.1016/j.redox.2021.102156
总的来说,作者阐明了RDN在动脉粥样硬化发生过程中修复内皮功能障碍的机制,为RDN在高血压合并动脉粥样硬化患者中的应用奠定了基础。此外,增加的去甲肾上腺素溢出通过
MAO-A 介导的线粒体炎症回路调节 EC 表型的发现可能为动脉粥样硬化治疗提供非常富有成效的治疗靶点。(生物谷
Bioon.com)
参考文献
Zhuqing Li et al. Targeting mitochondria-inflammation circle by renal denervation reducesatheroprone endothelial phenotypes and atherosclerosis. Redox Biol 2021 Sep 29;47:102156. doi: 10.1016/j.redox.2021.102156.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。