Nat Commun: CD177调节肿瘤浸润调节性T细胞的功能和稳态
来源:本站原创 2021-10-12 17:08
调节性T (Treg)细胞是癌症中主要的免疫抑制细胞类型之一,也是免疫治疗的潜在靶点,但靶向肿瘤浸润(TI) Treg细胞一直是一个挑战。
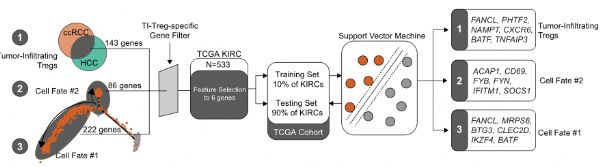
调节性T (Treg)细胞是癌症中主要的免疫抑制细胞类型之一,也是免疫治疗的潜在靶点,但靶向肿瘤浸润(TI) Treg细胞一直是一个挑战。在这里,作者使用来自肾透明细胞癌(ccRCC)患者的免疫细胞的单细胞RNA测序,确定了TI Treg细胞的两种不同的转录命运,Fate-1和Fate-2。在ccRCC和其他几种实体癌中,Fate-1特征与较差的预后有关。
CD177 是一种通常在中性粒细胞上表达的细胞表面蛋白,在几种实体癌类型的 Fate-1 TI Treg 细胞上特异性表达,但不在其他 TI 或外周 Treg 细胞上表达。从机制上讲,阻断 CD177 降低了体外 Treg 细胞的抑制活性,而 Cd177 的 Treg 特异性缺失导致小鼠肿瘤生长减少和 TI Treg 频率降低。因此,该结果揭示了一个功能性CD177+ TI Treg群体,可能作为TI Treg特异性免疫治疗的靶点。
图片来源:https://doi.org/10.1038/s41467-021-26091-4
Treg细胞是一类T细胞,对包括CD8 CD4+ T细胞、自然杀伤细胞、树突状细胞+ T细胞在内的多种免疫细胞具有抑制作用。Treg细胞在维持正常的免疫稳态和外周耐受中发挥着不可或缺的作用。它们在肿瘤微环境中的抑制活性与抗肿瘤免疫的丧失有关,这为 Treg 靶向免疫疗法的发展提供了理论基础。Treg细胞是通过转录因子forkhead box P3 (FOXP3)的表达识别出来的,FOXP3是Treg发育和抑制功能的主要调控因子。FOXP3不能单独预测患者的生存,它的预后价值取决于不同癌症的肿瘤类型和分期。最近的研究也揭示了FOXP3+ Treg细胞在外周血(PB)以及结直肠癌、胶质瘤等不同肿瘤类型中的功能异质性。所有Treg功能的破坏可能会对免疫稳态产生负面影响,正如在与CTLA-4阻断相关的自身免疫并发症中所见,这强调了对TI-Treg细胞更精细靶点的需求。
最近两项独立研究对血液来源、正常组织驻留细胞和TI Treg细胞的RNA测序显示,正常组织和TI Treg细胞之间的转录重叠。TI Treg细胞表现出相当数量的差异上调基因,包括趋化因子受体8 (CCR8)、CTLA4、淋巴细胞激活基因3 (LAG3)、t细胞膜蛋白3 (tim3,由HAVCR2编码)、layin (LAYN)和MAGE家族成员H1 (MAGEH1)。来自Rudensky小组的一份报告确认了CD177+ TI Treg细胞在乳腺癌中的作用,但没有进一步的功能阐述。利用小鼠脾细胞进行的全面的单细胞RNA测序也确定了小鼠脾Treg细胞中一小部分Cd177的表达。
CD177(也称为NB1, na
-2a,或PRV1)是一种糖基磷脂酰肌醇连接的细胞表面蛋白,由中性粒细胞异质性表达,已被确定为骨髓增生性疾病的有用生物标志物。作者制造了一个Cd177敲除(KO)小鼠模型,并证明了Cd177在中性粒细胞活力中的潜在作用。有限的文献表明CD177表达缺失与结直肠癌和胃癌的不良预后相关。研究表明,CD177在乳腺癌的上皮细胞中表达,其表达与较好的预后相关。作者进一步发现,癌细胞表达的CD177通过调节β-catenin的激活具有抑制肿瘤的功能。
为了研究TI Treg细胞的转录异质性,作者对3例ccRCC患者的PB和TI免疫细胞进行了单细胞rna测序。作者选择 ccRCC 基于这些肿瘤对免疫检查点抑制剂 (ICI) 的反应性,尽管它们的突变负荷较低,这意味着肿瘤微环境在介导对 ICI 的敏感性方面的重要性。研究表明,在ccRCC中,Treg基因标记与较差的预后有关,Treg浸润ccRCC肿瘤与基于il -2的免疫治疗和靶向治疗反应差有关。
预后预测的改善与抑制性TI Treg细胞命运的信号有关
图片来源:https://doi.org/10.1038/s41467-021-26091-4
在这里,作者通过将数据集与来自 HCC 数据集的免疫细胞的单细胞测序配对,证明存在转录和功能不同的 TI Treg 群体。最重要的是,TI Treg细胞中包括BCL2L128和CD177在内的几个基因相对于其他TI T细胞或PB Treg细胞有较高的表达。因此,该数据支持CD177在实体癌TI Treg细胞的特定人群中特异性表达,并且CD177能够介导TI Treg细胞在癌症中的抑制活性。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。