Science Advances:揭示朊病毒蛋白病理聚集多态性分子机制
来源:武汉大学 2021-09-26 12:48
Science Advances(影响因子14.136)以长文(Research Article)形式在线发表梁毅教授的最新研究成果,该工作在原子水平上解析了朊病毒蛋白病理突变体E196K纤维的高分辨率冷冻电镜结构,揭示了朊病毒蛋白病理聚集多态性的分子机制。论文题为“Genetic prion disease—related mutation E
Science Advances(影响因子14.136)以长文(Research Article)形式在线发表梁毅教授的最新研究成果,该工作在原子水平上解析了朊病毒蛋白病理突变体E196K纤维的高分辨率冷冻电镜结构,揭示了朊病毒蛋白病理聚集多态性的分子机制。
论文题为“Genetic prion disease—related mutation E196K displays a novel amyloid fibril structure revealed by cryo-EM”(家族遗传性prion疾病相关病理突变体E196K淀粉样纤维的冷冻电镜结构及功能),武汉大学为第一署名单位,生命科学学院博士后王利强、中国科学院生物与化学交叉研究中心博士研究生赵焜和武汉大学生命科学学院2020级博士研究生袁菡烨为共同第一作者,梁毅教授和中国科学院生物与化学交叉研究中心刘聪教授为通讯作者,华中农业大学生命科学技术学院殷平教授和武汉大学生命科学学院2019级博士研究生李香凝等参与了该论文的研究工作。这项研究工作得到了国家自然科学基金委和国家科技部的资助。
由朊病毒蛋白(PrP)在体内发生错误折叠所导致的传染性海绵状脑病(又称prion疾病)是一种慢性并可在多种哺乳动物之间传播的致死性神经退行性疾病。1997年诺贝尔生理或医学奖得主Prusiner S. B.最先描述了朊病毒(prions),即蛋白质感染因子。根据发病特征,Prion疾病分为散发性、家族遗传性和感染性三种类型,家族遗传性prion疾病的发生与朊蛋白基因PRNP的突变密切相关,已发现引起家族遗传性prion疾病的PrP突变位点共33个,包含42种家族遗传性prion疾病。这些不同的病理突变体可以形成朊病毒不同的株型,引起不同的临床症状,导致不同疾病的发生,如克雅氏病(Creutzfeldt-Jakob disease, CJD)、致死性家族失眠症(fatal familial insomnia, FFI)和格斯特曼氏综合征(Gerstmann-Str?ussler-Scheinker disease, GSS)等。
在野生型人朊病毒蛋白纤维冷冻电镜结构及功能前期工作(2020年6月8日发表于Nature Structural & Molecular Biology(《自然·结构与分子生物学》)中,梁毅教授研究团队解析了全长野生型朊蛋白纤维的结构,首次在原子水平上揭示了PrP由细胞型朊蛋白(PrPC)向病理型朊病毒蛋白(PrPSc)结构转变的机制,启示不同的病理突变体在调节朊病毒蛋白构象转化中可能发挥着不同的作用。然而朊病毒蛋白病理聚集多态性的分子机制是什么仍是困扰科学界的谜题。
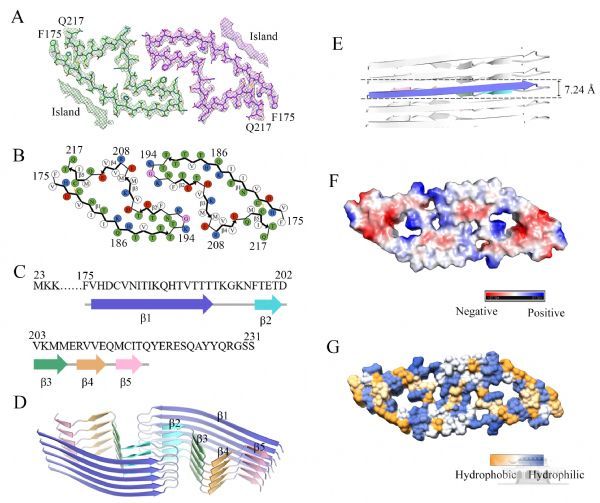
基于前期积累,该研究在原子水平上解析了朊病毒蛋白病理突变体E196K纤维的高分辨率冷冻电镜结构(3.07 ?),发现E196K纤维核心主要由其C端的175-217组成。E196K纤维由两股原纤维以左手螺旋的方式缠绕而成,纤维宽度为22 nm,纤维核心直径是11 nm,半个螺旋周期为126.4 nm。E196K纤维每股原纤维的核心包含5个b-折叠结构(从b1到b5)。在E196K聚集过程中,两股原纤维通过来自两个亚基的Lys194和Glu207之间以及Lys196和Glu200之间形成的4对盐桥发生相互作用,形成一个长的之字形相互作用界面。同时,对于E196K纤维每个亚基包含一个亲水腔这样新奇的结构,研究团队对于其病理学意义进行了探索,发现E196K纤维也能和刚果红结合,而且其蛋白酶抗性和构象稳定性均显着低于野生型PrP纤维。这项工作的实验结果表明,在E196K错误折叠过程中,E196K PrPC C端的两个a-螺旋转变成E196K纤维的五个b-折叠结构,Cys179和Cys214之间的二硫键起到了稳定淀粉样纤维结构的作用。
这项工作的研究结果首次揭示了E196K纤维和野生型PrP纤维之间的关键结构差异:(1) E196K纤维形成的是亲水空腔,而野生型PrP纤维则形成了疏水空腔;(2) E196K纤维形成的是既包含亲水又包含疏水的原纤维界面,而野生型PrP纤维则形成了短的亲水原纤维界面;(3) E196K纤维形成了5个b-折叠结构,而野生型PrP纤维形成了6个b-折叠结构;(4) E196K纤维相较野生型纤维具有更不稳定的构象。这项研究在原子水平上揭示了朊病毒株型形成分化的机制,证明不同株型的家族性病理突变能够破坏朊病毒蛋白纤维中重要的相互作用(例如盐桥),使得这些病理突变体纤维结构形成了完全不同于野生型朊病毒蛋白纤维的构象,因此不同的病理突变体在调节朊病毒蛋白构象转化中可能发挥着不同的作用,并使得发展新的基于PrP纤维结构的prion疾病治疗药物成为可能,为PrPSc结构与致病功能的深入研究和回答“朊病毒株型是怎么形成的”奠定了分子基础,具有重要的科学意义。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。