研究揭示朊病毒蛋白病理聚集多态性的分子机制
来源:上海有机化学研究所 2021-09-11 09:49
中国科学院上海有机化学研究所生物与化学交叉中心研究员刘聪课题组与武汉大学教授梁毅课题组合作,在Science Advances上在线发表了题为Genetic prion disease–related mutation E196K displays a novel amyloid fibril structure revealed b
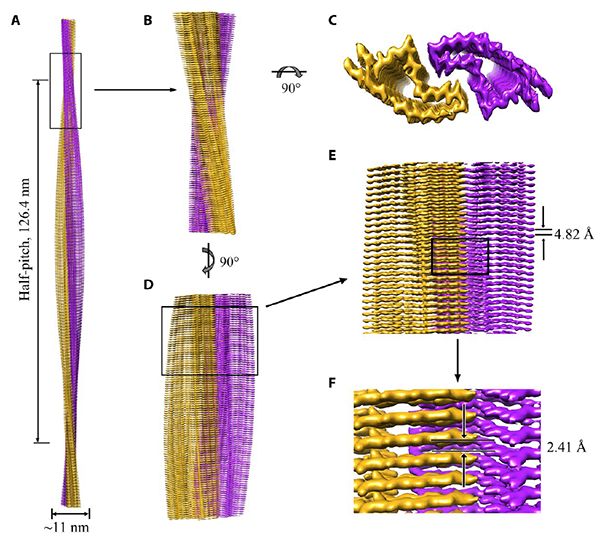
中国科学院上海有机化学研究所生物与化学交叉中心研究员刘聪课题组与武汉大学教授梁毅课题组合作,在Science Advances上在线发表了题为Genetic prion disease–related mutation E196K displays a novel amyloid fibril structure revealed by cryo-EM的研究论文。该工作利用冷冻电镜技术解析了全长朊病毒蛋白家族遗传病理性突变体E196K蛋白纤维的近原子分辨率结构,发现E196K突变通过破坏野生型朊病毒蛋白病理纤维中的关键相互作用力,导致纤维结构的重排,进一步揭示出不同朊病毒蛋白病理突变体聚集多态性的分子机制。
Prion疾病是由朊病毒蛋白(prion protein, PrP)发生错误折叠,聚集形成致病性的朊病毒(PrPSc)导致的神经退行性疾病,该疾病可在多种动物包括人类之间传播。其病理特征主要为细胞中具有正常构象的朊蛋白(PrPC)发生错误折叠形成病理型的朊病毒蛋白(PrPSc)。Prion疾病分为散发性、家族遗传性和感染性三种类型,家族遗传性prion疾病的发生与朊蛋白基因的突变密切相关。已发现引起家族遗传性prion疾病的PrP突变位点共33个,包含42种不同氨基酸的突变。不同的病理突变体可以形成多种不同的朊病毒株型,引发不同临床症状,导致不同疾病,例如克雅氏病(Creutzfeldt-Jakob disease, CJD)、致死性家族失眠症(fatal familial insomnia, FFI)和格斯特曼氏综合征(Gerstmann-Straussler-Scheinker disease, GSS)等。然而,病理性突变体如何改变朊病毒蛋白结构,不同朊病毒蛋白病理性突变体如何引起不同病理临床症状等问题尚未解决。
该研究中,研究人员对克雅氏病(CJD)家族性突变位点E196K开展研究。研究人员制备出高度均一、分散的全长人源朊蛋白病理突变体E196K淀粉样纤维,并运用冷冻电镜技术在近原子水平上解析了E196K纤维的高分辨率冷冻电镜结构(3.04 ?)。研究发现,E196K突变破坏了野生型朊病毒纤维中的关键相互作用力,导致纤维结构的重排,形成了与野生型朊病毒纤维完全不同的结构。该结构由两根原纤维以左手螺旋的方式缠绕而成,纤维核心宽度约为11 nm,半螺旋周期为126.4 nm(图1)。
进一步研究发现,E196K纤维核心主要由其C端的175-217组成,包含5个β-折叠结构。在E196K纤维结构中,来自两个亚基的Lys194、Lys196、Glu200和Glu207组成四对盐桥,形成了一个同时包含亲水氨基酸和疏水氨基酸的锯齿形相互作用界面(图2)。研究揭示出朊病毒蛋白病理突变体引起聚集纤维多态性的分子机制,为发展相关诊断和治疗手段提供了分子基础,具有重要意义。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


