SEMIN IMMUNOL:营养供应和饮食对肿瘤微环境中T细胞的代谢调节
来源:生物谷 2021-09-15 16:13
新陈代谢是一组基本的细胞过程,不仅维持细胞的存活和增殖,而且作为细胞解释其所在环境的一种手段,同时,营养感应对于T细胞至关重要,这些T细胞必须渗透到具有代谢挑战性的肿瘤微环境(TME)中,并在这些恶劣条件下扩展以消除癌细胞。
用于治疗癌症的免疫检查点阻断(ICB)和嵌合抗原受体T细胞(CAR-T)等免疫疗法的最新进展令人兴奋,因为它们能够在多种癌症中产生持久且可能治愈的反应,这些发现已经确定免疫系统能够消除肿瘤,并使人们对肿瘤与免疫系统相互作用和逃避免疫系统破坏的机制有了更好的理解,尽管还不完整。鉴于T细胞在免疫治疗中的核心作用,阐明控制肿瘤中T细胞功能细胞的内在和外在因素将促进免疫疗法的发展从而在更多患者中建立持久的反应,而这其中的一个因素是新陈代谢。
新陈代谢是一组基本的细胞过程,不仅维持细胞的存活和增殖,而且作为细胞解释其所在环境的一种手段,同时,营养感应对于T细胞至关重要,这些T细胞必须渗透到具有代谢挑战性的肿瘤微环境(TME)中,并在这些恶劣条件下扩展以消除癌细胞。
图片来源:https://doi.org/10.1016/j.smim.2021.101485
该研究介绍了与细胞代谢相关的T细胞耗竭,然后讨论了与T细胞代谢和功能相关的肿瘤和生物体水平的营养可用性,为抗肿瘤免疫中的代谢研究和靶向提供了理论依据。
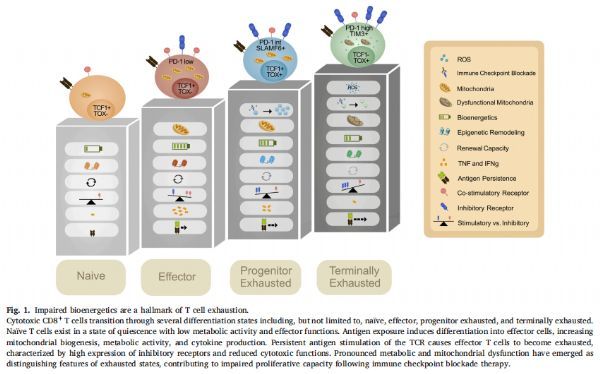
受损的生物能量学是T细胞衰竭的标志 图片来源:https://doi.org/10.1016/j.smim.2021.101485
在持续性抗原和T细胞抗原受体(TCR)信号存在的情况下,例如在肿瘤或慢性感染中,细胞毒性T细胞获得衰竭表型,其特征是抑制性受体(例如程序性死亡受体1(PD-1)、细胞毒性T淋巴细胞相关蛋白4(CTLA-4)、T细胞免疫球蛋白和含粘蛋白结构域的蛋白3(TIM3)和淋巴细胞活化基因3(LAG3))的表达增加,以及减少效应细胞因子的产生(例如肿瘤坏死因子(TNF)、干扰素γ(IFNγ)和白介素2(IL-2))和增殖。
该研究从癌症和慢性感染的实验模型中发现,T细胞耗竭是一系列分子亚型,其特征在于不同的表面标志物和转录谱,高迁移组非组蛋白盒(HMG-box)的转录因子胸腺细胞选择相关高迁移率群盒蛋白(TOX)已被确定为诱导衰竭T细胞分化的关键转录因子,随着这些抗原特异性细胞进一步分化为更多的终末耗竭细胞(TCF1-PD1high),TOX表达持续,细胞上调额外的共抑制分子(TIM3、LAG3、T细胞免疫球蛋白和ITIM结构域蛋白(TIGIT)、簇分化抗原101(CD101)),进一步限制增殖和效应功能。
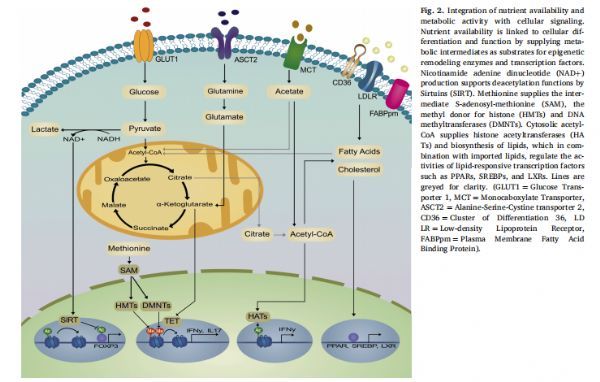
营养可用性和代谢活动与细胞信号的整合 图片来源:https://doi.org/10.1016/j.smim.2021.101485
T细胞利用葡萄糖作为碳的主要来源来产生ATP并维持多种代谢途径,葡萄糖代谢的调节对于适当的T细胞亚群分化很重要。PD-1信号在许多衰竭表型出现之前抑制糖酵解代谢,表明代谢重组是CD8+T细胞衰竭的关键组成部分,然而,代谢重组的时间、持续时间和幅度在这个过程中也起着重要作用。在活化的CD8+T细胞中加强糖酵解代谢会损害长期存活和抗原再攻击后的扩增,而在糖酵解抑制剂2-脱氧葡萄糖(2-DG)存在下激活CD8+T细胞可促进分化为长寿命记忆T细胞,同样的,CD4+T细胞谱系(辅助性T淋巴细胞1(Th1)、Th2 和Th17)是高度糖酵解的,用2-DG抑制糖酵解会使CD4+T细胞向调节性T细胞(Treg)分化。
除了能量学之外,葡萄糖还支持组蛋白修饰所必需的代谢中间体的合成,例如细胞溶质乙酰辅酶A,这是Th1细胞中IFNγ启动子和基因体的组蛋白乙酰化所必需的。另一方面,丙酮酸到乳酸的转化和氧化磷酸化(OXPHOS)产生NAD+,这是组蛋白去乙酰化酶(HDAC)的沉默信息调节因子(SIRT)家族的必要辅因子,SIRT1通过去乙酰化Treg分化的主要调节因子叉头框蛋白P3(FOXP3)来抑制Treg功能从而导致其降解。
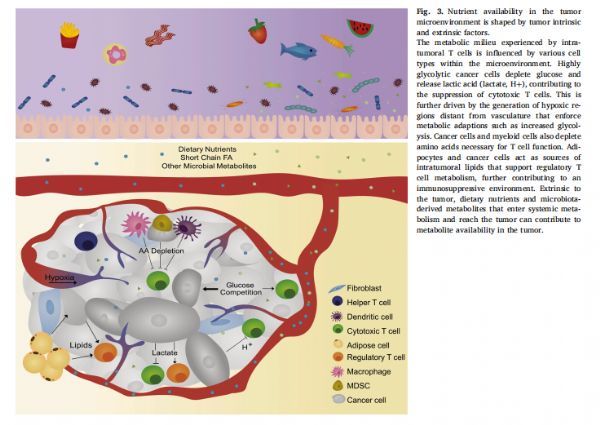
肿瘤微环境中的营养可用性受肿瘤内在和外在因素的影响 图片来源:https://doi.org/10.1016/j.smim.2021.101485
除了肿瘤和组织水平的转录中介因子(TIF)差异之外,有研究将确定的氨基酸代替天然蛋白质来源替代小鼠饲料后显著改变了血浆和TIF中的营养成分,表明膳食营养素从循环传递到TME,然而,膳食营养素在多大程度上可以改变肿瘤的营养环境仍然是未知的。此外,尽管有证据表明肥胖和II型糖尿病(T2D)等代谢疾病是多种癌症的真正危险因素,但紊乱的全身代谢如何影响肿瘤中的免疫反应尚不清楚。
肿瘤内T细胞经历的代谢环境受微环境内各种细胞类型的影响,高度糖酵解的癌细胞消耗葡萄糖并释放乳酸,有助于抑制细胞毒性T细胞;癌细胞和骨髓细胞也会消耗T细胞功能所必需的氨基酸;脂肪细胞和癌细胞作为肿瘤内脂质的来源,支持调节性T细胞代谢进一步促进免疫抑制环境,进入全身代谢并到达肿瘤的饮食营养素和微生物群衍生代谢物对于肿瘤而言是外在的,这有助于肿瘤中代谢物的可用性。
该研究突出了T细胞适应不同养环境的惊人能力,然而,这些适应可能是耐受性的,因此在肿瘤和免疫治疗的背景下是不可取的,强调了需要使用生理相关模型来研究癌症中的免疫代谢,通过这些模型来概括细胞和代谢异质性以及全身代谢的贡献。(生物谷 bioon)
参考文献
Steven Zhao et al. Metabolic regulation of T cells in the tumor microenvironment by nutrient availability and diet. SEMINARS IN IMMUNOLOGY(2021 Aug 27) doi:https://doi.org/10.1016/j.smim.2021.101485
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。