自噬受体蛋白NDP52的结构和作用机制研究方面取得进展
来源:上海有机所 2021-09-01 08:29
细胞自噬是哺乳动物细胞中高度受调控的,依赖溶酶体来降解受损细胞器、入侵病原体、大型蛋白聚集体等成分以应对内外界细胞压力和维持细胞动态平衡的重要分解代谢过程。自噬受体蛋白(autophagy receptor)是一类在选择性细胞自噬过程中发挥举足轻重作用的衔接蛋白,它可以作为一个桥联蛋白把目标底物与自噬体联系起来,从而介导目标底物的选择
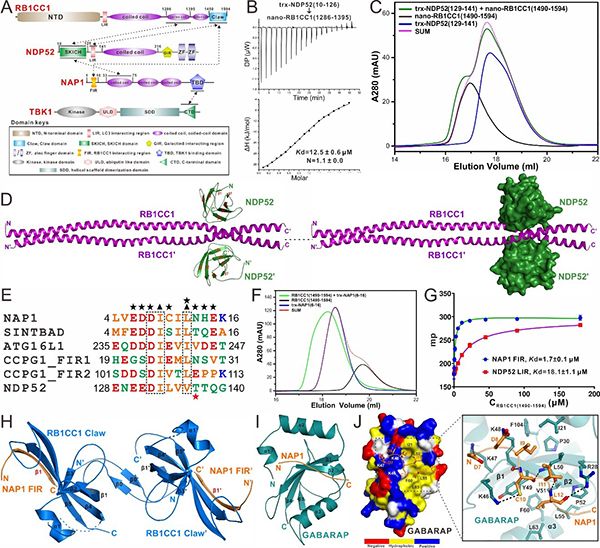
细胞自噬是哺乳动物细胞中高度受调控的,依赖溶酶体来降解受损细胞器、入侵病原体、大型蛋白聚集体等成分以应对内外界细胞压力和维持细胞动态平衡的重要分解代谢过程。自噬受体蛋白(autophagy receptor)是一类在选择性细胞自噬过程中发挥举足轻重作用的衔接蛋白,它可以作为一个桥联蛋白把目标底物与自噬体联系起来,从而介导目标底物的选择性自噬过程。众多人类疾病,比如克罗恩病(Crohn disease)、神经退行性疾病等,均与自噬受体蛋白的功能异常或缺失相关。NDP52是哺乳动物细胞中一个重要的自噬受体蛋白,在入侵的病原体(如鼠伤寒沙门氏菌)、受损线粒体的选择性自噬过程中发挥重要作用。近年来针对自噬受体蛋白NDP52的研究取得了长足进展,但是许多重要的深层次作用机制没有得到很好地阐述。中国科学院上海有机化学研究所生命有机化学国家重点实验室潘李锋研究团队长期致力于自噬受体蛋白NDP52的结构和作用机制研究。研究团队组前期的相关研究工作系统阐明了自噬受体蛋白NDP52识别泛素蛋白、TBK1相关脚手架蛋白NAP1和分子马达蛋白Myosin VI的结构基础和相关分子机制。
近期,该研究团队在Science Advances发表了题为Structural and biochemical advances on the recruitment of the autophagy-initiating ULK and TBK1 complexes by autophagy receptor NDP52的研究论文。团队首先利用凝胶共迁移、等温量热滴定、分析型超速离心技术、液体核磁共振等多种实验方法,详细研究了自噬受体蛋白NDP52与自噬起始ULK复合物亚基RB1CC1之间的相互作用,首次发现除了其SKICH结构域可以结合RB1CC1的C端第二个Coiled-coil区域外,NDP52的非经典LIR区域也可以特异性地结合RB1CC1的Claw结构域,表明NDP52会采用双位点的作用模式来结合RB1CC1。随后,利用X射线单晶衍射技术,该团队首次解析了NDP52 SKICH/RB1CC1 Coiled-coil复合物的晶体结构,并基于团队过去解析的NDP52的SKICH结构域结合NAP1的复合物结构,发现NDP52的SKICH采用完全不同的区域和作用模式去结合RB1CC1和NAP1。有趣的是,后续的研究表明RB1CC1和NAP1会通过别构效应竞争结合NDP52的SKICH结构域,但是由于NAP1中FIR模序的存在可以介导RB1CC1/NDP52/NAP1三元复合物的形成。同时,该团队也解析了NAP1的FIR模序结合RB1CC1的Claw结构域的复合物结构,详细阐明了NAP1结合RB1CC1的分子机制。后续基于氨基酸序列的比对分析,发现NAP1的FIR与NDP52的非经典LIR具有非常相似的序列类型,并进一步通过点突变等生化实验证实NDP52的非经典LIR模序也采用相似的作用模式去结合RB1CC1的Claw结构域,进而系统阐明了NDP52和RB1CC1之间相互作用的分子机制。此外,通过相关生化研究,该团队还发现与NDP52的LIR类似,NAP1的FIR也可以选择性地识别ATG8家族蛋白,并进一步解析了NAP1的FIR结合GABARAP的复合物结构,揭示了NAP1识别ATG8家族蛋白的分子机制。同时,通过phos-tag胶、磷酸化质谱分析等实验方法证明了TBK1能通过磷酸化NDP52中LIR模序的T137残基来增强NDP52与ATG8家族蛋白之间的相互作用,并发现RB1CC1的Claw结构域和ATG8家族蛋白会竞争结合NDP52的LIR模序。
综上所述,该研究工作揭示了自噬受体蛋白NDP52特异性地通过双位点的作用模式来结合RB1CC1的分子机制,同时,发现TBK1激酶对NDP52的磷酸化修饰能进一步增强NDP52对ATG8家族蛋白的结合,揭示了NAP1的FIR模序对RB1CC1/NAP1/NDP52三元复合物形成的重要作用。该研究工作的相关实验结果表明自噬受体蛋白NDP52在识别自噬底物后可能先通过结合RB1CC1招募ULK复合物,并通过NAP1招募TBK1激酶,原位介导自噬前体的产生,同时激活的TBK1可通过磷酸化NDP52来增强其结合ATG8家族蛋白的能力,从而进一步促进后续自噬前体的延伸和闭合过程。因此,该研究工作从生化和结构角度对NDP52、NAP1、RB1CC1、ATG8家族蛋白间相互作用的分子机制提供了新见解,扩展了领域内对于自噬受体蛋白NDP52介导的选择性自噬过程的分子机制的认识。 (生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


