SCI IMMUNOL:一种高亲和力的人类TCR样抗体检测乳糜泻谷蛋白肽-MHC复合物并抑制T细胞活化
来源:生物谷 2021-09-01 15:58
T细胞受体(TCR)样抗体已成功用于检测和量化细胞上的肽呈递,几项研究表明了不同模式的治疗潜力,包括抑制致病性T细胞和杀死抗原呈递细胞(APC)的机制,该研究发现TCR样抗体对涉及乳糜泻(CeD)的pMHC复合物具有特异性。
对肽-主要组织相容性复合体(pMHC)具有特异性的抗体(Abs),即所谓的T细胞受体(TCR)样抗体,已成功用于检测和量化细胞上的肽呈递,几项研究表明了不同模式的治疗潜力,包括抑制致病性T细胞和杀死抗原呈递细胞(APC)的机制。研究者已经生成了TCR样抗体,这些抗体对涉及乳糜泻(CeD)的pMHC复合物具有特异性。
图片来源:https://doi.org/10.1126/sciimmunol.abg4925
CeD是一种小肠炎症性自身免疫病,由对膳食麸质蛋白的免疫反应引起,这种疾病是由CD4+T细胞驱动的,这些细胞在疾病相关的人类白细胞抗原(HLA)-DQ分子HLA-DQ2.5(DQA1*05/DQB1*02)、HLA-DQ2.2(DQA1*02:01/DQB1*02:02)和HLA-DQ8 (DQA1*03/DQB1*03:02)的背景下识别脱酰胺谷蛋白肽,在这些HLA变体中HLA-DQ2.5与CeD的相关性最强,在大约90%的CeD患者中检测到,而在健康对照中检测到的比例约为20%。该研究报道了在HLA-DQ2.5:DQ2.5-glia-α1a上选择的Abs的产生和使用,发现肠道浆细胞(PC)是CeD患者发炎的小肠中最丰富的麸质肽呈递细胞,它们同时表达HLA-II类和T细胞共刺激分子,并描述了与DQ2.5-glia-α2复合的HLA-DQ2.5特异性人类TCR样抗体的产生和亲和力。
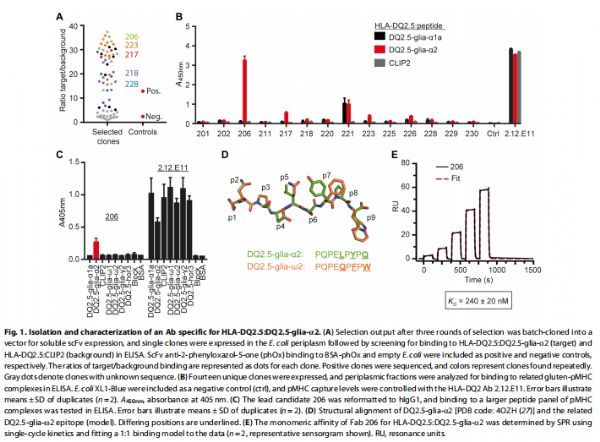
HLA-DQ2.5:DQ2.5-glia-α2特异性抗体的分离和表征 图片来源:https://doi.org/10.1126/sciimmunol.abg4925
为了生成与CeD表位DQ2.5-glia-α2复合的HLA-DQ2.5特异性人抗体,将人幼稚单链片段可变(scFv)噬菌体展示库与可溶性重组pMHC进行淘选,然后,将将噬菌粒的选择输出重新格式化为用于可溶性scFv表达的载体,并通过ELISA筛选了70个用于靶标结合的单克隆;共49个单克隆优先结合靶点,序列分析鉴定出14个独特序列。为了表征选定的scFv并选择一个先导克隆,研究者在大肠杆菌中表达了所有独特的克隆,并在ELISA中直接比较了周质部分的靶标结合;同时,使用纯化的scFv进行了先导表面等离子体共振(SPR)测量,根据反应性特征和表观亲和力,选择了一个先导克隆称为206。当重新格式化为全长人免疫球蛋白G1 (hIgG1)时,206保留了与HLA-DQ2.5:DQ2.5-glia-α2的结合,尽管结合很弱;未观察到与高度相似的表位HLA-DQ2.5:DQ2.5-glia-ω2的结合;为了准确确定单体亲和力,构建了206的Fab版本,通过SPR分析,以较高的偏差率估算了其与KD240±20nM的单体亲和力(2.4×10−1s−1)。
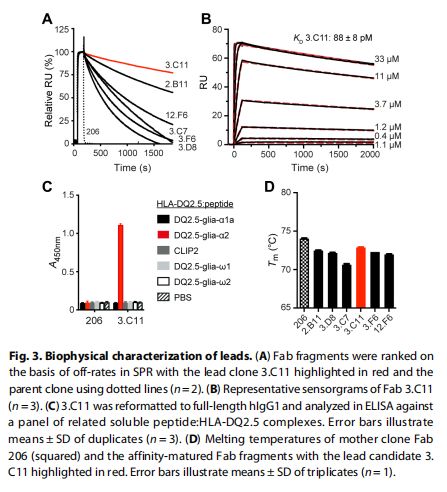
先导物的生物物理特征 图片来源:https://doi.org/10.1126/sciimmunol.abg4925
该研究通过SPR进行结合分析,并根据它们的解离率对六个Ab进行排名,用表现出最低解离率的克隆3.C11测试的所有克隆都观察到解离率显著降低;与改善的(较低)解离率一致,3.C11与KD88±8pM的亲和力显著改善,与亲本克隆相比改善了2700倍;3.C11随后表达为全长hIgG1并在ELISA中测试特异性结合发现,3.C11仅与HLA-DQ2.5:DQ2.5-glia-α2结合。,因此,高亲和力抗体保持了母克隆的高特异性。研究者接下来通过使用纳米级差示扫描荧光法(nanoDSF)确定它们的熔解温度来评估所有Fab片段的热稳定性发现,高亲和力变体的熔解温度比它们的母克隆略低,先导克隆3.C11具有最高的热稳定性,由于其有利的生物物理特性,3.C11作为进一步表征的主要候选物。
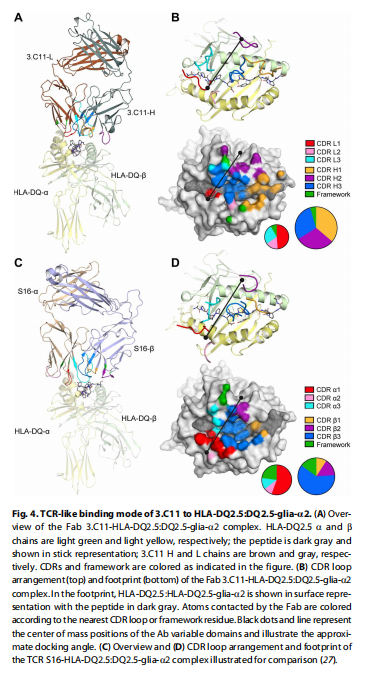
C11与HLA-DQ2.5:DQ2.5-glia-α2的TCR样结合模式 图片来源:https://doi.org/10.1126/sciimmunol.abg4925
为了解3.C11特异性和亲和力的分子基础,该研究获得了3.C11Fab片段和HLA-DQ2.5:DQ2.5-glia-α2的晶体复合物,结构分辨率为2.4-Å,该结构显示3.C11Fab以“TCR 样”对接模式结合HLA-DQ2.5:DQ2.5-glia-α2。为了表征3.C11的TCR样特征,将3.C11三元复合物的结构与S16 TCR的结构进行了比较,3.C11Fab将肽与所有CDR环接合,VL和VH质心位置与肽轴之间的角度为57°,因此,3.C11的VL和VH域分别占据了经典TCR Vα和Vβ域结合位点的位置。3.C11在HLA-DQ2.5:DQ2.5-glia-α2上的整体定位与S16三元复合物中的TCR相似,尽管3.C11VL和VH质心位置向HLA- DQ2.5α链螺旋分别比S16Vα和Vβ质心位置高3.7和6.1 Å,CDR环相对于pMHC的布局和3.C11的足迹也大致类似于S16TCR的布局,因此3.C11和S16共享大量pMHC接触残基。3.C11使用所有六个CDR环与pMHC相互作用,接触肽核心的九个氨基酸中的七个,发现这一特征表明肽具有高特异性;3.C11还与MHCα 和β链的几个残基结合,特别是IGHV1-69的强选择部分可以通过该种系片段的疏水性CDRH2与MHCα链形成强界面来解释。
虽然尚不清楚单独靶向免疫显性DQ2.5-glia-α2表位是否足以治疗CeD,但这些在T1D中使用TCR样抗体的研究是有希望的,因为它们表明高亲和力抗体抑制单个T细胞在复杂的自身免疫性疾病的临床前模型中,表位可能足以诱导更具耐受性的免疫反应并延迟疾病的发作或进展。因此,mAb3.C11有效防止T细胞活化的能力鼓励进一步研究以评估抑制、细胞毒性或诱导感染耐受性治疗CeD的治疗潜力。(生物谷 bioon)
参考文献
Rahel Frick et al. A high-affinity human TCR-like antibody detects celiac disease gluten peptide–MHC complexes and inhibits T cell activation. SCIENCE IMMUNOLOGY(2021 Aug 20) doi:https://doi.org/10.1126/sciimmunol.abg4925
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。