Journal for ImmunoTherapy of Cancer:前列腺癌B7评分与T细胞浸润分层免疫状态的关系
来源:生物谷 2021-08-26 17:54
根据癌症统计,前列腺癌(PCa)是全球发病率和死亡率的主要原因,对于局部PCa,有/无辐射的根治性前列腺切除术是主要的治疗策略。
根据癌症统计,前列腺癌(PCa)是全球发病率和死亡率的主要原因,对于局部PCa,有/无辐射的根治性前列腺切除术是主要的治疗策略。然而,雄激素剥夺疗法(ADT)仍然是晚期PCa患者或初级治疗失败患者的主要治疗方法,但大多数PCa病例最终还是死于肿瘤发展,称为去势抵抗性PCa (CRPC)。几十年来,CRPC的治疗选择一直受到限制,因此迫切需要探索新的治疗方案以加强或取代现有的治疗方法。
图片来源:http://dx.doi.org/10.1136/jitc-2021-002455
免疫检查点抑制剂(ICIs),尤其是程序性细胞死亡蛋白1 (PD-1)/程序性死亡配体1 (PD-L1) 轴阻滞剂对多种恶性肿瘤表现出显着的抗肿瘤作用,但它们对前列腺癌(PCa)患者的益处已经有些边缘了。PD-L1是B7超家族的成员,但PCa中的PD-L1表达很少见,并且没有足够的数据来保证使用PD-1/PD-L1轴抑制剂治疗PCa患者;B7-H3 (CD276)是另一个B7超家族成员,在大多数人类恶性肿瘤中异常表达,但其在免疫反应中的功能是有争议的,具有肿瘤内的共抑制和共刺激作用,这些明显的差异可能与不同肿瘤内肿瘤浸润免疫细胞(TIIC)的组成有关;HERV-H LTR-associating 2 (HHLA2, B7-H7/B7-H5)是新发现的B7家族成员,与B7-H3类似,HHLA2精确的生理功能尚未完全阐明,但在研究者之前的研究中发现9个PCa组织中有3个观察到阳性HHLA2染色。该研究旨在评估B7-H3或HHLA2作为PCa替代免疫治疗靶点的可行性。
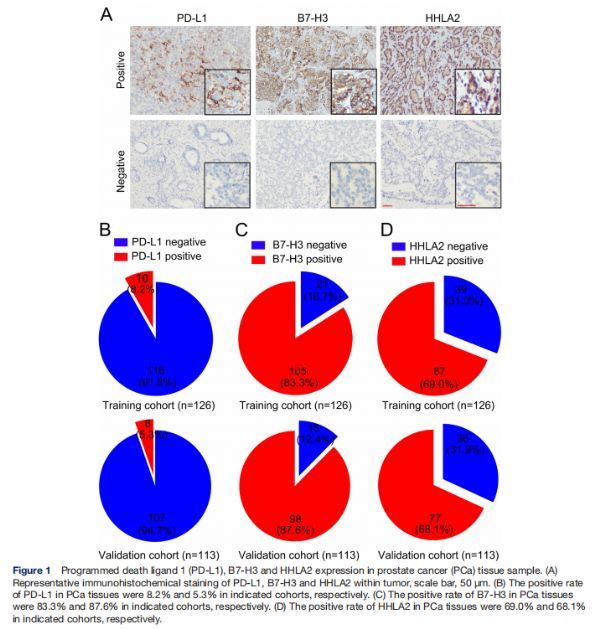
PD-L1、B7-H3和HHLA2在PCa组织样本中的表达 图片来源:http://dx.doi.org/10.1136/jitc-2021-002455
为了评估来自两个队列的PCa组织中PD-L1、B7-H3和HHLA2的表达谱,进行了免疫组织化学(IHC)实验,发现PD-L1在实验队列中的10个(8.2%)病例和验证队列中的6 个(5.3%)病例中呈阳性染色,B7-H3在实验队列中的105 (83.3%)个PCa病例和验证队列中的98 个(87.6%) 病例中广泛表达,就HHLA2而言,两个队列中分别有87例(69.0%)和77例(68.1%)PCa病例检测到HHLA2阳性染色。这些数据表明,与PD-L1表达相比,B7-H3和HHLA2在PCa组织中的表达频率更高。
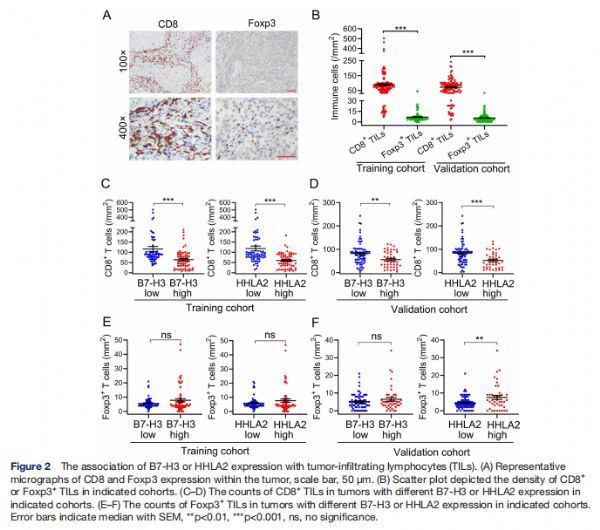
B7-H3或HHLA2表达与肿瘤浸润淋巴细胞(TIL)的关联 图片来源:http://dx.doi.org/10.1136/jitc-2021-002455
两个队列中CD8+TIL的密度远高于Foxp3+TIL的密度(两个队列中p<0.001),在两个队列中,在B7-H3或HHLA2表达低的肿瘤中检测到的CD8+TIL密度显着高于B7-H3或HHLA2表达高的肿瘤(实验队列:B7-H3,p<0.001,HHLA2,p<0.001;验证队列:B7-H3,p<0.01,HHLA2,p<0.001)。相反,在任一队列中,高B7-H3表达的肿瘤和低B7-H3的肿瘤之间没有观察到Foxp3+TIL的显着差异,在训练队列中未观察到HHLA2表达与Foxp3+TIL之间的显着相关性,然而,在验证队列中,高密度的Foxp3+TIL与高HHLA2表达显着相关。这些结果表明B7-H3和HHLA2可能是PCa组织内免疫抑制环境的原因。
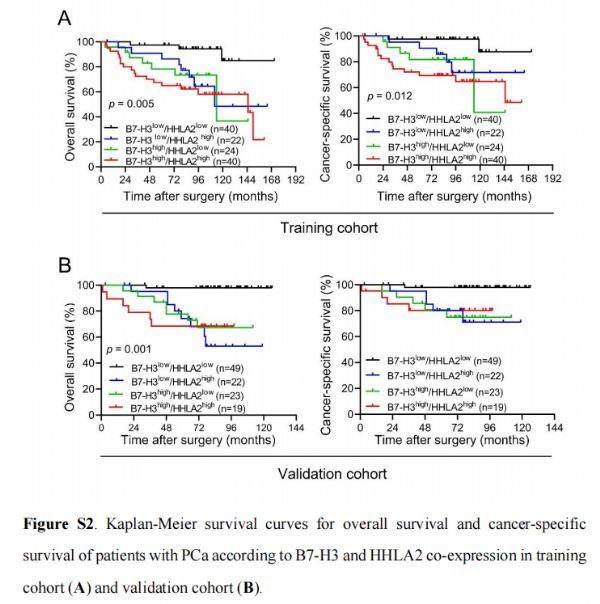
根据实验队列(A)和验证队列(B)中B7-H3和HHLA2共表达的PCa患者总体生存率(OS)和癌症特异性生存率(CSS)的Kaplan-Meier 生存曲线 图片来源:http://dx.doi.org/10.1136/jitc-2021-002455
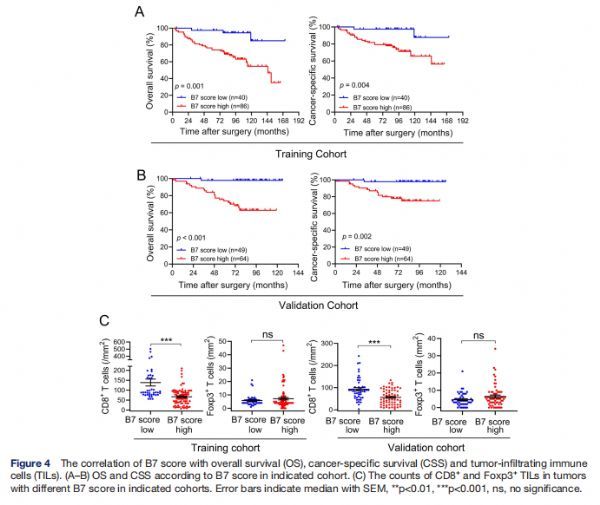
B7评分与OS、CSS和TIL的相关性 图片来源:http://dx.doi.org/10.1136/jitc-2021-002455
先前的一项研究表明,CD8+TILs的广泛浸润可以独立预测PCa的良好预后,尽管B7-H3和HHLA2与CD8+TILs的浸润密切相关,但B7-H3和HHLA2都不是独立的预后因素。为了进一步确定B7-H3和/或HHLA2表达与PCa患者预后之间的关系,研究者试图根据B7-H3和 HHLA2 的表达生成预测生存的潜在工具。根据B7-H3和HHLA2的表达将PCa患者分为以下四组:组I(B7-H3low/HHLA2low),组II(B7-H3low/HHLA2high),组 III (B7-H3high/HHLA2low) 和组IV(B7-H3high/HHLA2high)。在两个队列中,Kaplan-Meier分析表明,II-IV组患者的OS和CSS比I组患者短,但在两个队列中的II-IV组患者之间没有检测到显着差异,并且高B7得分显著对两个队列的OS和CSS进行分层(实验队列,OS:p=0.001,CSS:p=0.004; 验证队列,OS:p<0.001,CSS:p=0.002),高B7分数与高密度的CD8+ TIL呈负相关(两个队列中的p<0.001)。然而,在任一队列中均未检测到Foxp3+ TIL与B7-H3或HHLA2表达之间的相关性。
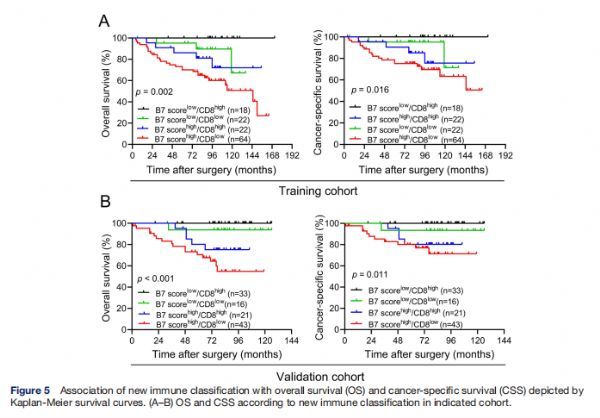
新免疫分类与Kaplan-Meier生存曲线描绘的OS和CSS的关联 图片来源:http://dx.doi.org/10.1136/jitc-2021-002455
基于上述发现,研究者根据B7评分和CD8+TIL的密度开发了一种新的免疫分类方案,将PCa患者分为四种免疫类型:免疫I型(低B7评分,高CD8+TIL),免疫II型(低B7评分,低CD8+TIL),免疫III型(高B7评分,高CD8+TIL)和免疫IV 型(高B7评分,低CD8+TIL)。在实验队列中,这四种类型的PCa患者比例分别为14.3% (18/126)、17.5% (22/126)、22% (22/126)和50.8% (64/126),而在验证队列的113名PCa患者中,29.2% (n=33)属于免疫I型,14.2% (n=16)属于免疫II型,18.6% (n=21)属于免疫III型和38.1% (n=43)属于免疫IV型。 根据Kaplan-Meier分析,在两个队列中具有四种免疫类型的患者中,IV型免疫与最差的OS和CSS更显着相关,而免疫I型与改善的OS和CSS显著相关,甚至在随访期间没有观察到死亡,但在任一队列中,免疫II或III型之间的OS和CSS均未发现差异。这种新的免疫分类可能为预测预后和免疫治疗结果提供方向。
该研究证明B7-H3和HHLA2均与免疫抑制微环境相关,B7评分可作为PCa的独立预后因素,并在B7评分和CD8+ TIL的基础上建立了一个新的免疫分类,这可能对PCa患者的OS和CSS 进行显著分层,但研究者评估的免疫标记的表达水平仅根据相应的截止值分为高或低,为了提高可靠性,需要更大的样本量队列来确定确切的截止值;尽管免疫标记之间存在显着相关性,但需要多种免疫荧光检测来确认不同免疫标志物之间的关联。(生物谷 bioon)
参考文献
Qianghua Zhou et al. B7 score and T cell infiltration stratify immune status in prostate cancer. Journal for ImmunoTherapy of Cancer (2021 Aug 20) doi:http://dx.do.org/10.1136/jitc-2021-002455
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。