肿瘤干细胞研究进展(第8期)
来源:本站原创 2021-07-31 23:55
2021年7月31日讯/生物谷BIOON/---恶性肿瘤是严重威胁人类生命的疾病之一。对于多数恶性肿瘤患者而言,可采用化疗、放射疗法及生物免疫治疗等方法来杀死大部分肿瘤细胞,但是却无法从根本上治愈肿瘤。肿瘤干细胞(Cancer Stem Cell,CSC),也被称作癌干细胞,或癌症干细胞,是指肿瘤中具有自我更新能力并能产生异质性肿瘤细胞的细胞。现在已经很清楚
2021年7月31日讯/生物谷BIOON/---恶性肿瘤是严重威胁人类生命的疾病之一。对于多数恶性肿瘤患者而言,可采用化疗、放射疗法及生物免疫治疗等方法来杀死大部分肿瘤细胞,但是却无法从根本上治愈肿瘤。
肿瘤干细胞(Cancer Stem Cell,CSC),也被称作癌干细胞,或癌症干细胞,是指肿瘤中具有自我更新能力并能产生异质性肿瘤细胞的细胞。现在已经很清楚肿瘤干细胞在肿瘤恶化和产生治疗抗性中起了重要作用,最突出的表现在血液系统癌症如白血病中。因此,有学 者提出了肿瘤干细胞在肿瘤发生、发展、转移过程中都有重要作用,但到底什么是肿瘤干细胞现在尚无准确定义。肿瘤干细胞和肿瘤组织细胞不同。这些细胞自身分化较慢,但对很多物理化学损伤(如放疗和化疗)耐受。据说化疗和放疗还能促进肿瘤干细胞的增殖。肿 瘤干细胞被认为是肿瘤治疗复发的根源,因为即使多数肿瘤细胞被杀死,只要肿瘤干细胞还在,根据定义这些干细胞可以分化成肿瘤细胞。这一理论为我们重新认识肿瘤的起源和本质,以及临床肿瘤治疗提供了新的方向和视觉角度。
近年来肿瘤干细胞学说受到越来越多人的关注,并在乳腺癌、脑肿瘤、前列腺癌、肺癌、肝癌、结直肠癌、皮肤癌等多种恶性肿瘤中都成功分离出了肿瘤干细胞。基于此,小编针对肿瘤干细胞的研究进行一番梳理,以飨读者。
1.Hepatology:癌症相关成纤维细胞通过CLCF1−CXCL6/TGF-β信号轴介导细胞通讯交流来促进肝细胞癌进展
doi:10.1002/hep.31792
癌症相关成纤维细胞(CAFs, cancer-associated fibroblasts)是肿瘤微环境(TME, tumor microenvironment)中的重要细胞组分,也是导致肝细胞癌(HCC)发病的关键因素。然而,CAFs与TME中其他细胞组分之间的通讯交流模式和机制尚不明确。来自中山大学的夏建川课题组在Hepatology杂志上发文研究探讨了肝癌发病的不同阶段,CAFs、肿瘤细胞和肿瘤相关中性粒细胞(TANs, tumor-associated neutrophils)之间的细胞通讯交流。
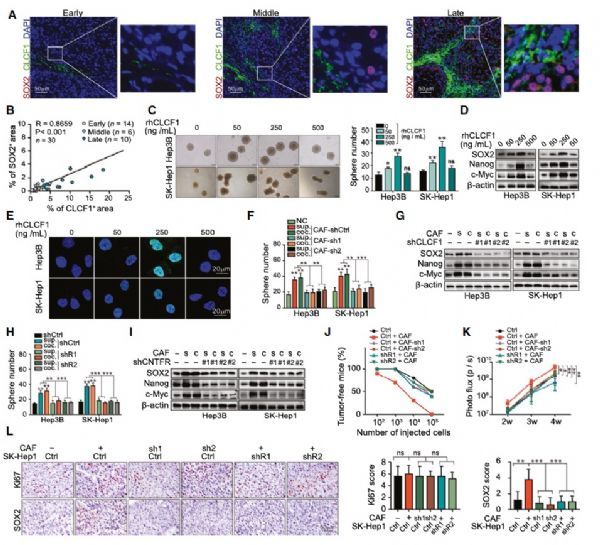
CLCF1通过与其受体CNTFR相互作用,增强了HCC细胞的自我更新能力。
2.Nat Biomed Eng:将癌症连根拔起!特殊双网凝胶或能将癌细胞重编程转换为癌症干细胞 有望开发新型抗癌疗法!
doi:10.1038/s41551-021-00692-2
癌症的复发常常是因为罕见的循环癌症干细胞(CSCs,circulating cancer stem cells)对化疗和放疗产生耐受性所致。日前,一篇发表在国际杂志Nature Biomedical Engineering上题为“Rapid reprogramming of tumour cells into cancer stem cells on double-network hydrogels”的研究报告中,来自北海道大学等机构的科学家们通过对6种不同的人类癌细胞类型进行研究,成功在24小时内将癌细胞转换回了癌症干细胞,相关研究结果或有望帮助开发新型抗癌干细胞药物和个体化疗法。
癌症干细胞需要一种非常特殊的微环境,这篇研究报告中,研究人员调查了是否DN凝胶(双网凝胶,double-network hydrogel)能够重现这种合适的环境来诱导癌症干细胞,DN凝胶由两种化学物质组成的网络,其中含有大量的水分,这就赋予了DN凝胶具有类似生物组织的柔软和湿润特性。研究者发现,DN凝胶能在24小时内将6种不同类型的人类癌细胞系的癌细胞重编程使其分化为癌症干细胞;这6种类型的癌症包括脑癌、子宫癌、肺癌、结肠癌、膀胱癌和肉瘤。当将癌细胞置于DN凝胶上时,其就会开始形成球状结构并产生癌症干细胞的特殊分子标志物,比如SOX2和Oct3/4和Yamanaka因子等,这就指示,这些癌细胞发生了重编程。
此外,研究人员还揭示了参与癌细胞重编程的部分分子机制,结果发现,钙离子通道受体和特殊蛋白—骨桥蛋白(osteopontin)对于诱导癌症干细胞非常必要;而且在DN凝胶上培育的脑癌细胞还能产生名为血小板衍生生长因子受体的特殊受体分子。通过添加这些受体的分子抑制剂,研究人员就能靶向作用并剔除癌症干细胞,这就表明,DN凝胶或能用来帮助筛选治疗性药物,此外,当将在DN凝胶上培育的脑癌细胞植入到小鼠大脑中后,其就能有效快速形成肿瘤组织,这就揭示了癌细胞的“干性”。
3.Cell Stem Cell解读!科学家开发出新型DNA疗法有望清除癌症干细胞并成功治愈多发性骨髓瘤!
doi:10.1016/j.stem.2020.12.017
日前,一篇刊登在国际杂志Cell Stem Cell上题为“Selective antisense oligonucleotide inhibition of human IRF4 prevents malignant myeloma regeneration via cell cycle disruption”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究开发出了一种新型DNA疗法,或有望帮助清除小鼠机体中的癌症干细胞并帮助治疗多发性骨髓瘤。多发性骨髓瘤是一种血液癌症,很多多发性骨髓瘤患者最终会对多种疗法产生一定的耐受性,部分原因是癌症干细胞会驱动疾病细胞不断自我更新,如果一种疗法不能完全摧毁这些恶性干细胞,癌症很可能会继续复发。
这项研究中,研究人员开发出了一种针对多发性骨髓瘤的新型靶向性疗法,即沉默基因IRF4的表达,IRF4基因能允许骨髓瘤干细胞和肿瘤细胞增殖和存活,此前多项研究表明,高水平的IRF4与多发性骨髓瘤患者总体生存率下降直接相关。文章中,研究人员描述了如何利用反义寡核苷酸来成功抑制IRF4的功能并促进其降解,反义寡核苷酸是一种专门设计用来结合编码IRF4遗传物质的DNA,根据临床前的研究数据,这种寡核苷(由lonis公司开发的研究性反义药物,被称为ION251)酸能够帮助降低患者的疾病负担,并减少骨髓瘤干细胞的丰度及增加携带人类骨髓瘤的小鼠的存活率。

图片来源:researchoutreach.org。
4.Nat Cancer:脑癌与组织修复之间的关系
doi:10.1038/s43018-020-00154-9
在最近一项研究中,来自多伦多的科学家发现,脑损伤后的愈合过程可能会刺激肿瘤的生长,因为新产生的细胞可以替代因损伤而丢失的细胞。这项发现是由多伦多大学,病童医院(SickKids)和玛格丽特公主癌症研究中心的跨学科研究小组完成的。
研究人员应用了最新的单细胞RNA测序和机器学习技术来绘制胶质母细胞瘤干细胞(GSCs)的分子组成图,Dirks的研究小组此前证明,这些细胞可导致肿瘤的发生和治疗后的复发。
他们发现了新的GSC亚群,它们具有炎症的分子标志,并且与患者肿瘤内的其他癌症干细胞混合在一起。这表明某些胶质母细胞瘤在正常的组织愈合过程中开始形成,这种过程会产生新的细胞来替代因受伤而丢失的细胞,并因突变而脱轨,甚至可能在患者出现症状之前很多年就消失了。
根据这项研究,一旦突变细胞参与伤口愈合,它就无法停止繁殖,因为正常的对照被破坏了,从而刺激了肿瘤的生长。
5.Cell Stem Cell:阻断蛋白质的生物合成或有望遏制癌症干细胞的功能
doi:10.1016/j.stem.2020.04.012
肿瘤中并非都是均一的细胞,结肠癌中就含有分化样的细胞(其类似于肠壁的功能性细胞)和所谓的肿瘤干细胞(多潜能细胞),肿瘤干细胞会促进肿瘤生长并引发癌症转移,近日,一项刊登在国际杂志Cell Stem Cell上的研究报告中,来自巴塞罗那生物医学研究所等机构的科学家们就通过研究发现,结肠癌干细胞多潜能性的本质就是其合成蛋白质的能力,而这一特性或能被研究人员用来作为靶点开发新型的抗癌疗法。
这项研究中,研究者观察到肿瘤中蛋白质的合成会发生在于癌症干细胞生境相一致的特定区域,此外,肿瘤也会展现出蛋白产生的梯度,一旦活性被耗尽,肿瘤细胞就会不可逆地失去其回归到癌症干细胞状态的能力,因此,这种生物合成能力会使得癌症干细胞无限制地促进肿瘤生长。研究者表示,本文研究或能帮助我们基于功能而并非个性来清除癌症干细胞,下一步研究者将会深入研究调查是否有可能通过治疗性地干预肿瘤干细胞的生物合成能力来阻断肿瘤的生长和转移。
图片来源:IRB Barcelona。
这项研究中研究人员利用类器官进行研究,即在实验室中培养出的衍生自患者机体的迷你肿瘤组织,这或许就能帮助研究者研究肿瘤细胞的异质性和组织架构;类器官的培养系统同时也是一种强大的工具,其能模拟患者机体中发现的癌症的特性,此外,本文研究中,研究者还利用CRISPR-Cas9调查了肿瘤细胞的遗传修饰状况,该技术能帮助研究者特异性地清除具备生物合成能力的肿瘤细胞,同时还能分析其在促进肿瘤生长过程中的贡献。
6.Nat Commun:鉴定出肾癌干细胞,并发现阻断WNT和NOTCH有潜力治疗肾癌
doi:10.1038/s41467-020-14700-7
在一项新的研究中,来自德国马克斯-德尔布吕克分子医学中心等研究机构的研究人员发现了导致肾癌最常见形式---透明细胞肾细胞癌(clear cell renal cell carcinoma, ccRCC)---的肾癌干细胞。他们在这种疾病的三种模型中找到了一种阻止肿瘤生长的方法。相关研究结果近期发表在Nature Communications期刊上,论文标题为“Inhibiting WNT and NOTCH in renal cancer stem cells and the implications for human patients”。论文通讯作者为马克斯-德尔布吕克分子医学中心的Walter Birchmeier教授。论文第一作者为Birchmeier实验室博士后研究员Annika Fendler博士。
并非所有癌细胞都是一样的。肿瘤中含有强有力的癌症干细胞(cancer stem cell,也译作肿瘤干细胞,癌干细胞),这些癌症干细胞会产生转移性肿瘤,如果它们逃避治疗,那么它们就会让疾病复发。如果科学家们能够分离出它们并探究其弱点,这将使它们成为治疗的重要靶标。但是这些细胞通常非常稀少,以至于尚未在许多类型的癌症中发现它们。
Birchmeier及其团队鉴定出肾癌干细胞并发现它们存在的弱点。它们依赖于两种关键的生化信号。在这种疾病的多个实验室模型中,阻断这两种生化信号就会阻止肿瘤生长,这提示着一种有前景的治疗人类肾癌患者的新方法。
7.Cell Stem Cell:新研究揭示人胶质母细胞瘤的起源
doi:10.1016/j.stem.2019.11.015
胶质母细胞瘤是脑癌中最具侵袭性的形式,它在大脑中迅速生长和扩散,几乎不可能根除,通常会在诊断后一两年内导致死亡。科学家们一直在寻求更有效的靶向疗法,但到目前为止还没有取得成功,这部分上是原因是这类肿瘤在实验室环境中难以研究。美国加州大学旧金山分校博士后研究员Aparna Bhaduri博士说,“胶质母细胞瘤在患者中具有侵袭性和顽强性,但在实验室中一直很难存活。在以前针对小鼠的胶质母细胞瘤研究中,在移植到它们的体内后,只有5%到10%的人类肿瘤能够存活下来,这使得我们猜测这类肿瘤可能在许多重要的方面不同于那些不能存活的肿瘤。”
如今,在一项新的研究中,Bhaduri、加州大学旧金山分校伊莱-艾迪斯布罗德再生医学与干细胞研究中心Arnold Kriegstein实验室博士后研究员Elizabeth Di Lullo博士首次在实验室中使用人大脑类器官---由人干细胞培育出的脑组织球状体---成功地让多种胶质母细胞瘤存活。相关研究结果发表在2020年1月2日的Cell Stem Cell期刊上,论文标题为“Outer Radial Glia-like Cancer Stem Cells Contribute to Heterogeneity of Glioblastoma”。

胶质母细胞瘤细胞(绿色)入侵由人干细胞(蓝色)培育出的大脑类器官,图片来自University of California, San Francisco。
他们发现胶质母细胞瘤似乎并非起源于单个细胞类型(其他人称之为“胶质母细胞瘤干细胞”),而是起源于多种种子细胞(seed cell),包括一种看起来和在行为上非常类似于Kriegstein实验室在十年前发现的称为外放射状胶质细胞(outer radial glia cell, oRG)的神经干细胞。
8.两篇Cell子刊揭示寨卡病毒入侵大脑干细胞机制,利用这种机制有望治疗致命性的脑癌
doi:10.1016/j.celrep.2019.11.020; doi:10.1016/j.stem.2019.11.016
在两项新的研究中,来自美国加州大学圣地亚哥分校医学院的两个研究团队独立地鉴定出相同的分子---αvβ5整合素---是寨卡病毒入侵大脑干细胞的关键。他们还发现了利用这种整合素来阻止寨卡病毒感染细胞并让它发挥有益作用的方法:减少脑癌干细胞。
在第一项新的研究中,加州大学圣地亚哥分校医学院的Tariq Rana博士及其研究团队使用CRISPR基因编辑系统性地剔除了在实验室培养皿中进行三维培养的人胶质母细胞瘤干细胞(glioblastoma stem cell, GSC,一种脑癌干细胞)中的每个基因。随后,他们让每种GSC细胞突变体暴露于寨卡病毒,以便确定哪些基因及其编码的蛋白是这种病毒入侵GSC细胞所必需的。这种病毒首次用绿色荧光蛋白(GFP)加以标记,从而允许这些研究人员可视化观察这种病毒入侵这些细胞。相关研究结果于2020年1月16日在线发表在Cell Reports期刊上,论文标题为“Integrin αvβ5 Internalizes Zika Virus during Neural Stem Cells Infection and Provides a Promising Target for Antiviral Therapy”。
Rana团队发现了92个特异性的人脑癌干细胞基因是寨卡病毒入侵这种细胞并在其中复制所需要的。但是,其中的一个基因尤其重要,它就是编码αvβ5整合素的基因。
在第二项新的研究中,鉴于了解很多病毒使用整合素入侵人细胞,加州大学圣地亚哥分校医学院的Jeremy Rich博士及其研究团队使用不同的抗体来抑制每种整合素,以便观察哪种抗体具有最好的抑制效果。相关研究结果于2020年1月16日在线发表在Cell Stem Cell期刊上,论文标题为“Zika Virus Targets Glioblastoma Stem Cells through a SOX2-Integrin αvβ5 Axis”。
Rich说,“当我们阻断其他整合素时,效果上并没有区别。但是用抗体阻断αvβ5几乎可以完全阻断这种病毒感染脑癌干细胞和正常大脑干细胞的能力。”
Rich团队随后在胶质母细胞瘤小鼠模型中利用抗体抑制αvβ5,或者让编码它的基因失活。这两种方法都可阻止寨卡病毒感染,并且允许这些经过治疗的小鼠比未治疗的小鼠活得更长。他们还发现阻断在外科手术期间从患者身上取出的胶质母细胞瘤肿瘤样本中的αvβ5可阻断寨卡病毒感染。
9.Sci Rep:鉴别出癌症干细胞的新型生物标志物 有望开发出高效抗癌疗法
doi:10.1038/s41598-019-51004-3
在癌症生物学的世界里,并不是所有生物标志物都是一样的,这些分子能够提醒医生患者机体中不正常的过程可能正在进行,其会以一系列异常蛋白的形式出现,比如激素、酶类或信号分子等,而且其因人而异。由于其是一组混合物,因此并没有一种药物能有效对其进行靶向作用;近日,一项刊登在国际杂志Scientific Reports上的研究报告中,来自休斯顿大学等机构的科学家们通过研究在癌症干细胞中发现了一种新型的生物标志物,其或能指挥癌症的生存和扩散,相关研究结果或有望帮助研究人员开发新型药物来靶向作用癌症干细胞,从而抑制癌症进展。
研究者Gomika Udugamasooriya表示,我们在癌症干细胞中发现了这种名为网蛋白(plectin)的新型生物标志物,网蛋白或能作为一种新型靶点帮助研究人员开发可用的抗癌药物;网蛋白是一种特殊的结构蛋白,其主要在细胞内进行表达,但其在细胞表面上的易位于肿瘤的侵袭性和转移发生直接相关。
研究者Udugamasooriya表示,我们的研究结果表明,网蛋白和肺癌干细胞之间或许存在遗传型和表型关联,而且高水平的网蛋白往往与肺腺癌患者较低的存活率直接相关,这就表明,网蛋白或许能作为肺癌干细胞的特殊生物标志物。网蛋白能帮助重塑细胞,其对于癌症扩散至关重要,能帮助癌症干细胞在机体中扩散。
10.Nat Cell Biol:治疗胰腺癌的新靶点
doi:10.1038/s41556-019-0407-1
近日,来自克里克大学的研究人员发现了一种蛋白质可促进胰腺癌的生长,这一蛋白可能成为新的胰腺癌治疗的靶标。相关研究结果发表在最近的《Nature Cell Biology》杂志上。
在该研究中,研究人员分析了一组被称为“肿瘤干细胞“的亚群,这些细胞具有分化产生新肿瘤干细胞的能力,并且它们还可以分化为不同类型的肿瘤细胞亚群。通过分析这些癌症干细胞的基因表达,研究小组发现,无论是在肿瘤发展早期还是后期,肿瘤该细胞表明均表达一种名为CD9的蛋白质。因此,这种蛋白质可以用来作为标记,以帮助找到上述细胞亚群。
图片来源:Www.pixabay.com。
这些发现与现有临床数据不谋而合,后者显示肿瘤细胞中CD9含量较高的患者的预后效果较差。“这些细胞对胰腺癌的发展至关重要,因此,我们需要找到有效的方法去除这些细胞,从而阻止它们对癌症的发展的促进作用。但是,我们需要更多的实验来验证CD9在人类胰腺癌中的重要性。” Crick成人干细胞实验室的主要作者和成员Victoria Wang说。为了了解CD9促进癌症恶化的机制,研究小组研究了癌症干细胞的代谢情况。他们的发现表明,CD9可增加细胞摄取谷氨酰胺的速率,而谷氨酰胺是一种氨基酸,有助于为癌症的生长提供能量。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


