Trends Immunol:缺氧和HIF-1是肠道微生物区系和宿主相互作用的关键调节因子
来源:本站原创 2021-07-26 15:27
氧(O2)利用率是调节脊椎动物肠道粘膜微生物区系组成和细胞动态平衡功能的关键因素。微生物代谢产物增加了肠上皮细胞(IECS)对O2的消耗,降低了其在肠道中的利用率,并导致缺氧。这种生理性缺氧激活细胞缺氧感受器,以适应IECS和粘膜驻留细胞的新陈代谢和功能,如3型先天淋巴细胞(ILC3s)。在这篇综述中,作者讨论了最近的证据表明,微生物区系、缺氧/缺氧感受器和
氧(O2)利用率是调节脊椎动物肠道粘膜微生物区系组成和细胞动态平衡功能的关键因素。微生物代谢产物增加了肠上皮细胞(IECS)对O2的消耗,降低了其在肠道中的利用率,并导致缺氧。这种生理性缺氧激活细胞缺氧感受器,以适应IECS和粘膜驻留细胞的新陈代谢和功能,如3型先天淋巴细胞(ILC3s)。在这篇综述中,作者讨论了最近的证据表明,微生物区系、缺氧/缺氧感受器和哺乳动物宿主细胞(IECS和ILC3s)之间的复杂和多方向的相互作用决定了肠道屏障和宿主-微生物区系-病原体之间的联系是如何形成的。了解这些相互作用可能会为生物失调以及某些炎症性和传染性疾病提供新的治疗可能性。
图片来源:https://pubmed.ncbi.nlm.nih.gov/34171295/
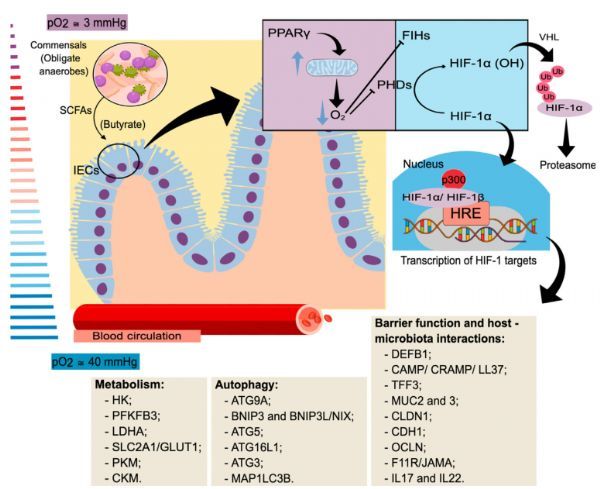
O2在人体内就像一把双刃剑。一方面,O2作为有氧呼吸中电子的最终接受者和分子形成的几个反应的参与者,对细胞是必不可少的。另一方面,它也可以转化为活性氧(ROS),这可能会对细胞产生有害的影响。考虑到这一双重方面,生物体进化出几种专门调节这种分子的摄取、运输和使用的机制也就不足为奇了。
在细胞水平上,有一些系统可以感知O2浓度的变化并对其做出反应,O2浓度的变化是多细胞生物体生存和成功的重要因素。在这方面起作用的最著名的感受器之一是缺氧诱导因子。缺氧诱导因子的活性主要受缺氧诱导因子-α的稳定性和反式激活潜能的调节,并受氧调节蛋白的调节,包括脯氨酰羟化酶(Phds)和因子抑制缺氧诱导因子(Flh)。
在脊椎动物中已经报道了三种hif-α亚基的亚基:hif-1α、hif-2α和hif-3α。它们移位到细胞核,与组成性表达的β亚单位一起形成复合物,并调节影响关键细胞通路的基因的表达,包括新陈代谢和自噬。
各种因素导致缺氧诱导因子反应的复杂性,包括它们也可以通过氧不依赖的机制被激活,而且它们是细胞特异性的。最近的一项研究比较了四种小鼠细胞类型(少突胶质细胞、T细胞、黑素细胞和胚胎心脏细胞)中的HIF-1α靶基因,发现所有这些细胞中只有51个基因(典型的HIF-1靶基因)存在。相比之下,观察到的细胞特异性HIF-1靶点要多得多。HIF-1α和转录因子寡突胶质细胞转录因子(OLIG2)的富集,以及寡突胶质细胞特异性HIF-1靶基因的开放染色质状态(与其他组织特异性HIF-1靶基因相比),提示染色质可及性和染色质与细胞特异性转录因子之间的相互作用有助于解释某些细胞特异性反应。
哺乳动物肠道中的缺氧
图片来源:https://pubmed.ncbi.nlm.nih.gov/34171295/
综上所述,本综述中讨论的研究提供了有关不同炎症环境下缺氧诱导因子-1α稳定的可能结果的相关信息,并提示了这些结果可能在人类中所起的不同和复杂的作用。因此,缺氧和HIF-1通路的激活可能被认为是治疗某些炎症性和/或感染性疾病的潜在靶点,特别是那些影响肠道的疾病,如CDI、前IBD和IBD。然而,这样的可能性仍然是理论上的,由于缺氧/缺氧诱导因子-1靶向途径对宿主生理的多效性和复杂性的影响,需要极其谨慎地分析。我们还没有从这些突出问题中吸取教训,在治疗各种疾病时,我们应该对产生有害影响的可能性保持警惕。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。