Nature:新突破!揭示PLAAT磷脂酶导致晶状体细胞器降解,让视力清晰
来源:本站原创 2021-04-27 18:49
2021年4月27日讯/生物谷BIOON/---眼睛由三种主要组织类型组成;角膜、晶状体和视网膜。晶状体是一个双凸的透明结构,其功能类似于照相机镜头,允许光线通过并将其聚焦在视网膜上。白内障是晶状体透明度发生变化而阻碍光线通过的结果,在50岁及以上的成年人中,白内障几乎占了总失明病例的50%。因此,确定晶状体透明的机制可能会提高我们对白内障生物学的理解。在一
2021年4月27日讯/生物谷BIOON/---眼睛由三种主要组织类型组成;角膜、晶状体和视网膜。晶状体是一个双凸的透明结构,其功能类似于照相机镜头,允许光线通过并将其聚焦在视网膜上。白内障是晶状体透明度发生变化而阻碍光线通过的结果,在50岁及以上的成年人中,白内障几乎占了总失明病例的50%。因此,确定晶状体透明的机制可能会提高我们对白内障生物学的理解。
在一项新的研究中,来自日本东京大学等研究机构的研究人员提供了人们长期以来一直在寻找的关于晶状体在正常发育过程中如何实现透明的关键信息。相关研究结果发表在2021年4月22日的Nature期刊上,论文标题为“Organelle degradation in the lens by PLAAT phospholipases”。

由于晶状体具有较高的折射率,它可以很容易地弯曲光线,将其聚焦在视网膜上---这是晶状体中称为晶体蛋白(crystallin)的结构蛋白紧密包装的结果。晶体蛋白占成熟晶状体总质量的60%,比任何其他组织的蛋白浓度水平都要高得多。晶状体含有一类上皮细胞,这类细胞在进化时经历了一个独特的分化过程,使它们变得透明并将光散射降到最低。为了实现透明,细胞内的细胞器在发育过程中被降解,产生了所谓的晶状体无细胞器区(organelle-free zone)。细胞器的保留损害了晶状体的透明度,并导致白内障的形成。
一种称为自噬的细胞内降解途径---此前唯一已知的消除整个细胞器的途径---最初被认为是促成这种无细胞器区形成的原因。然而,科学家们随后发现,在自噬缺陷的小鼠的晶状体分化过程中,细胞器降解仍然发生。如今,在这项新的研究中,这些作者描述了一种以前未知的两步机制,通过这种机制,细胞器在晶状体中被清除。他们发现,这一机制在斑马鱼和小鼠中都是进化保守的。第一步包括形成使细胞器的脂质膜通透的小孔。这成为第二步的触发因素:招募一种酶来降解细胞器的脂质膜。
这些作者采取了一种基于显微镜的方法来监测斑马鱼晶状体中荧光标记的细胞器的降解情况。他们确定了在晶状体中高水平表达的基因,并使用一种基因编辑方法来阻断这些基因的表达,然后评估其影响。这揭示出基因hrasls是晶状体分化过程中细胞器降解所必需的。该基因编码一种磷脂酶,是HRASLS(也被称为PLAAT)蛋白家族的成员。这种酶催化了磷脂---细胞膜的主要结构成分---的分解。至关重要的是,他们报告说,在缺乏hrasls的斑马鱼和缺乏相应基因Hrasls3的小鼠中,细胞器在晶状体分化过程中被保留下来。这导致了晶状体透明度的缺陷,晶状体光折射功能的改变,以及白内障的出现。
这些作者发现斑马鱼中HRASLS的靶向性取决于这种蛋白的一个特定区域,即羧基末端跨膜结构域。HRASLS在细胞分化的早期阶段位于细胞膜上,然后在细胞膜降解前立即转移到包括线粒体、细胞核、溶酶体和内质网在内的细胞器中。这项研究首次证明了通过直接的脂质降解来降解整个细胞器。
在此之前,自噬是唯一已知的降解整个细胞器的过程。然而,在自噬过程中,降解是通过将细胞器送到溶酶体而发生的,溶酶体使用称为水解酶的酶来消化细胞器的各种成分,如蛋白、DNA和脂类。这些作者推测,在晶状体发育等情况下,依赖磷脂酶的途径可能比自噬更有效。这是因为晶状体发育需要消除许多类型的细胞器,包括溶酶体,而不是像自噬那样有选择地消除特定的细胞器。事实上,这是第一篇描述晶状体发育过程中溶酶体命运的论文。
晶状体分化是一个时空控制的过程,在这个过程中,位于晶状体中心的细胞器首先被降解,然后继续向外降解位于晶状体外围的细胞器。在参与这一过程的许多转录因子蛋白中,Hsf4具有突出的作用,编码Hsf4的基因发生突变与先天性白内障有关。这些作者发现,斑马鱼线粒体和溶酶体膜上小孔的形成是以Hsf4依赖的方式进行的,这作为HRASLS家族磷脂酶转移到这些细胞器的信号。他们报告说,溶酶体膜上的小孔的形成触发了它的内含物(包括一些DNA降解酶)部分释放到细胞质中。这发生在磷脂酶转移到溶酶体导致该细胞器的全部内含物释放之前。重要的是,他们证实溶酶体被成孔剂(pore-forming agent)破坏足以触发磷脂酶转移到溶酶体。
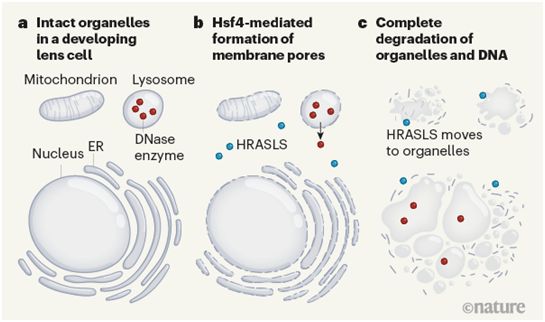
发育中晶状体内的细胞器降解机制,图片来自Nature, 2021, doi:10.1038/d41586-021-00888-1。
这一结果强调了溶酶体膜通透性在生理和发育背景下的关键作用,如在细胞分裂期间或在哺乳期之后的乳腺萎缩中。这些作者进一步发现,Hsf4介导的线粒体膜通透化也是斑马鱼HRASLS转移到线粒体所必需的,而且在Hsf4缺陷的斑马鱼中,线粒体的降解被抑制。
这些观察结果表明,Hsf4依赖性的细胞器膜的部分通透化是触发HRASLS转移到晶状体中的目标细胞器所需的信号。然而,膜通透化过程似乎与细胞类型有关,因为在人HeLa宫颈癌细胞中过量表达Hsf4和HRASLS3并不能诱发HRASLS3在这些细胞中转移到细胞器(称为过氧化物酶体的细胞器除外)。因此,Hsf4特异性地促进晶状体细胞的细胞器膜上形成小孔的确切机制仍有待确定。Hsf4调节晶状体细胞中溶酶体的活性和溶酶体的pH值。因此,很有可能推测晶状体中的细胞器降解是由溶酶体pH值和溶酶体小孔形成之间的Hsf4依赖性联系所介导的,因为pH值的改变影响溶酶体的膜稳定性。
还需要开展进一步的研究来解释这项研究的观察结果,即HRASLS3在HeLa细胞中的过度表达只导致一种细胞器---过氧化物酶体---的降解。这种选择性提供了一个额外的控制步骤,可能是由蛋白-蛋白相互作用介导的,或者也许是由于细胞器之间的差异,如其膜的组成或稳定性。然而,另一个难题是为什么HRASLS蛋白会降解晶状体细胞内的细胞器膜,而不针对这种细胞的外部边界--质膜--的膜脂。
鉴于HRASLS3在脂肪组织(帮助脂肪储存)中的高表达水平,了解HRASLS3是否在该组织的脂肪细胞分化过程中参与细胞器的降解将是很有趣的。未来的研究可以调查这些磷脂酶是否可以在基因改造后降解其他感兴趣的膜包围结构,如细胞内有害细菌的结构。同样值得研究的是,相关形式的HRASLS蛋白(人类有五个,小鼠有三个)是否也参与细胞器的降解。
这些作者的发现提供了一个精彩的例子,说明如何利用发育过程来解决复杂的问题。在这项研究中,视觉所需的细胞透明性是由于受调节的细胞器降解而产生的结果。这一过程是否参与了其他发育事件,以及它的异常是否导致了疾病,仍有待确定。(生物谷 Bioon.com)
参考资料:
Hideaki Morishita et al. Organelle degradation in the lens by PLAAT phospholipases. Nature, 2021, doi:10.1038/s41586-021-03439-w.
Patricia Boya. Lipid dismantling of lens organelles for clear vision. Nature, 2021, doi:10.1038/d41586-021-00888-1.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


