Mol Cell:细胞凋亡阶段Caspase切割核蛋白XRCC4调节细胞膜磷脂结构的改变
来源:本站原创 2021-04-03 06:28
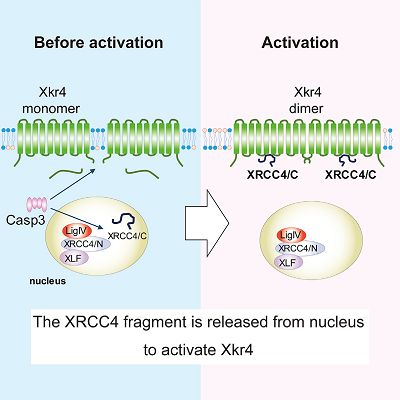
细胞濒临死亡时,其细胞膜中的磷脂分子结构会发生紊乱,进而促进磷脂酰丝氨酸的暴露,这是胞吐作用的关键过程。此前研究发现Xkr家族蛋白Xkr4对于磷脂分子结构的紊乱具有关键的作用,但其激活机制仍然未知。在最近一项研究中,来自日本京都大学的Jun Suzuki教授等人揭示了Xkr4被激活的两个步骤:caspase介导的切割形成的二聚体,以及激活因子引起的结构变化。
2021年4月3日讯/生物谷BIOON/---细胞濒临死亡时,其细胞膜中的磷脂分子结构会发生紊乱,进而促进磷脂酰丝氨酸的暴露,这是胞吐作用的关键过程。此前研究发现Xkr家族蛋白Xkr4对于磷脂分子结构的紊乱具有关键的作用,但其激活机制仍然未知。在最近一项研究中,来自日本京都大学的Jun Suzuki教授等人揭示了Xkr4被激活的两个步骤:caspase介导的切割形成的二聚体,以及激活因子引起的结构变化。为了确定参与该过程的关键因素,作者使用CRISPR sgRNA文库开发了一种新的筛选系统,即“存活筛选”。应用该系统,作者确定了核蛋白XRCC4是激活Xkr4的关键分子。当细胞凋亡发生后,DNA修复复合体中所含的XRCC4蛋白被caspase裂解,其C末端片段被释放到细胞质中,之后该片段与Xkr4二聚体相互作用并导致后者的激活。相关结果发表在《Molecular Cell》杂志上。
(图片来源:www.cell.com)
此前研究发现,细胞凋亡过程中caspase介导的C-末端切割会导致Xkr4蛋白的激活,而切割反应本身并不会导致磷脂酰丝氨酸分子的暴露。为了解释C末端切割与Xkr4活性之间的关系,作者首先进行了细胞学水平的筛选。结果表明,在表达全长的Xkr4分子以及caspaseC末端的细胞中,外界刺激会导致脂质结构的紊乱,而该过程依赖于caspase的活性,表明Xkr4的活性不仅依赖caspase本身的切割,同时还需要caspase的其它活性。此外,生化分析表明Xkr4与C末端肽段的二聚化不足以激活其活性。进一步,作者通过高通量突变的技术,筛选得到了若干株能够稳定出现磷脂膜结构紊乱的细胞克隆,上述克隆中Xkr4分子发生了一系列突变,导致其活性能够持续保持。
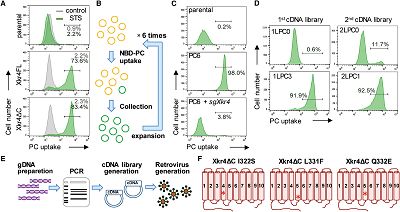

(cDNA文库筛选揭示Xkr4突变对磷脂膜结构的影响)
之后,作者对具备上述活性的Xkr4突变体进行了测序分析,发现了其中存在特定的单点突变,包括I322S, L331F, 或者Q332E。通过分别转染上述突变蛋白并进行功能学与结构学方面的分析,作者发现Xkr4的激活依赖两个独立的事件:二聚化以及结构变化。
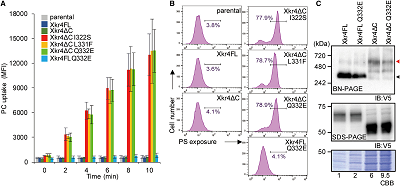

(图2,Xkr4突变株功能分析及其对磷脂膜结构的影响)
进一步,作者试图探究在自然条件下Xkr4激活的原因。通过高通量的CRISPR-cas9突变筛选,作者发现了一种叫做XRCC4的蛋白,此前研究表明XRCC4是DNA损伤修复复合体的成分,而该研究表明XRCC4蛋白的缺失会显著影响Xkr4蛋白破坏磷脂膜结构的活性。在此基础上,作者发现XRCC4受caspase3的切割而被激活,切割后的XRCC4的C末端能够从细胞核向细胞膜部位转移。在外界促凋亡刺激下,XRCC4能够调节Xkr4的活性,进而促进磷脂膜的紊乱与磷脂酰丝氨酸的暴露。(生物谷 Bioon.com)
原始出处:Masahiro Maruoka, Panpan Zhang, Hiromi Mori et al., Caspase cleavage releases a nuclear protein fragment that stimulates phospholipid scrambling at the plasma membrane. Molecular Cell (2021). DOI:https://doi.org/10.1016/j.molcel.2021.02.025
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


