抗病毒新药!武田maribavir 3期临床成功:将重新定义移植受者巨细胞病毒(CMV)感染/疾病治疗!
来源:本站原创 2021-02-16 23:58
maribavir疗效优于常规疗法,安全性更高。在中国,maribavir于2020年4月获得临床试验默示许可,用于治疗CMV感染或疾病。

2021年02月16日讯 /生物谷BIOON/ --武田制药(Takeda)近日在2021年移植与细胞治疗(TCT)会议上宣布了TAK-620-303(SOLSTICE,NCT02931539)试验的最新3期数据。该研究在难治性、有或无耐药性(R/R)的巨细胞病毒(CMV)感染/疾病的移植受者中开展,将在研抗病毒药物TAK-620(maribavir)与常规抗病毒药物(研究人员指定的治疗[IAT],以下一种或多种药物的组合:更昔洛韦[ganciclovir]、缬更昔洛韦[valganciclovir]、膦甲酸[foscarnet]、西多福韦[cidofovir])进行了对比。该研究的主要终点是治疗第8周(治疗期结束)确认的CMV病毒血症清除率,关键次要终点是CMV清除率和症状控制维持至第16周。
结果显示,maribavir与常规抗病毒治疗(IAT)相比疗效具有优越性,达到了研究的主要终点和关键次要终点。此外,maribavir与常规抗病毒治疗相比,治疗相关毒性更低。
CMV是β疱疹病毒亚科的DNA病毒,具有高度的种属特异性,人类是人巨细胞病毒(HCMV)的唯一宿主。CMV是一种常见的病毒,可感染所有年龄段的人群。到40岁时,超过一半的成年人已经感染CMV,大多数没有相关症状和体征。然而,在免疫力低下(包括器官或干细胞移植受者)的人群中,CMV感染是一种严重的临床并发症,可导致组织侵入性疾病,并最终致命。现有的抗病毒疗法可用于治疗CMV,但这些疗法可能因副作用和/或耐药性而应用受限。
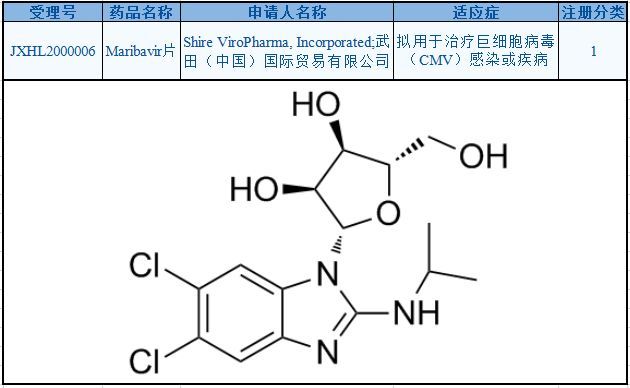
maribavir是一种口服生物可利用的抗巨细胞病毒(CMV)化合物,是目前唯一一种处于3期临床开发、在实体器官移植(SOT)或造血细胞移植(HCT)中用于治疗移植后患者CMV感染/疾病的抗病毒药物。在中国,maribavir于2020年4月获得临床试验默示许可,开发适应症为:用于治疗巨细胞病毒(CMV)感染或疾病。
武田副总裁兼maribavir全球项目负责人Obi Umeh医学博士表示:“我们对SOLSTICE试验的结果感到兴奋,在2021年TCT会议上分享的详细结果,对于CMV风险增加的移植患者来说是一个重要的进展,如果不加以控制,CMV感染/疾病可能会带来严重的挑战。maribavir如果获得批准,将有潜力重新定义移植后难治性CMV的治疗方法,不管有无耐药性。”
主要终点方面:在研究第8周,接受抗病毒治疗R/R CMV疾病/感染的移植受者中,实现确认的CMV病毒血症清除的患者比例方面,maribavir治疗组(55.7%,n=131/235)是常规治疗组(23.9%,n=28/117)的2倍以上(95%CI:32.8%,22.8-42.7;p<0.001)。主要终点的亚组分析(随机集)显示:(1)接受抗病毒治疗R/R CMV感染/疾病的实体器官移植(SOT)受者中,maribavir治疗组有55.6%实现确认的CMV病毒血症清除,而常规治疗组为26.1%;(2)接受抗病毒治疗R/R CMV感染/疾病的造血细胞移植(HCT)受者中,maribavir治疗组有55.9%实现确认的CMV病毒血症清除,常规治疗组为20.8%;(3)无论基线病毒载量类别如何(低载量[<9100IU/mL]、中/高载量[≥9100IU/mL]),接受抗病毒治疗R/R CMV感染/疾病的移植受者中,maribavir治疗组与常规治疗组相比均有更高比例的患者在第8周实现确认的CMV病毒血症清除(低载量组:62.1% vs 24.7%;中/高载量组:43.9% vs 21.9%)。
关键次要终点方面:数据显示,maribavir在清除CMV病毒血症和维持相关症状控制直至第16周方面优于常规抗病毒药物方案。关键次要终点分析(随机集)显示:接受maribavir治疗的移植受者中,有18.7%(44/235)在研究第16周维持CMV病毒血症清除和症状控制,而接受常规治疗的移植受者中为10.3%(12/117)(p=0.013)。
该研究中,接受maribavir治疗的移植受者表现出较低的治疗相关毒性,而这些毒性在常规抗病毒治疗中很常见。具体而言,接受maribavir治疗的移植受者,与缬更昔洛韦/更昔洛韦治疗的移植受者相比治疗相关中性粒细胞减少症的发生率更低(1.7%[4/234] vs 25%[14/56])、与膦甲酸治疗的移植受者相比治疗相关急性肾损伤的发生率更低(1.7%[4/234] vs 19.1[9/47])。maribavir组和常规治疗组中任何级别治疗期间出现的不良事件(TEAE)发生率分别为97.4%(228/234)和91.4%(106/116)。导致停药的TEAE在maribavir组为13.2%(31/234),在常规治疗组为31.9%(37/116)。发生2例治疗相关严重TEAE导致的死亡(每个治疗组1例)。
哈佛医学院医学副教授、布里格姆妇女医院副医师Francisco M. Marty表示:“我们很高兴SOLSTICE试验达到了主要终点,该试验在伴有复发性/难治性CMV感染的移植受者中将maribavir与可用的抗病毒治疗方案进行了比较。接受maribavir治疗的患者中,超过一半的患者能够在8周内成功治疗CMV感染,并且与目前可用的抗病毒治疗方案(分别为缬更昔洛韦/更昔洛韦和膦甲酸)相比,中性粒细胞减少和急性肾损伤更少。这些新发现是为移植受者寻找巨细胞病毒新疗法方面的一个重大进展。”

CMV(图片来源:std-gov.org)
巨细胞病毒(CMV)是一种β疱疹病毒,通常感染人类;40%-100%的成年人群中有先前感染的血清学证据。然而,免疫系统受损的个体可能会发生严重疾病,其中包括接受与各种移植(包括HCT或SOT)相关的免疫抑制剂的患者。CMV通常在体内潜伏且无症状,但在免疫抑制期间会重新激活。在每年估计的20万例成人移植中,CMV是移植受者最常见的病毒感染之一,估计SOT移植受者中的发生率为16-56%,HCT移植受者中的发生率为30-70%。CMV的再激活可能导致严重后果,包括移植器官的丧失,在极端情况下,可能是致命的。治疗移植后CMV感染的现有疗法可能显示出毒性,需要调整剂量,需要住院治疗,或者可能无法充分抑制病毒复制。
maribavir属于名为苯并咪唑核苷的一类药物,可靶向抑制CMV的UL97蛋白激酶,从而潜在影响CMV复制的几个关键过程,包括病毒DNA复制、病毒基因表达、衣壳化以及成熟衣壳从受感染细胞的细胞核中逃逸。
maribavir是一种口服可生物利用的抗病毒疗法,目前正处于III期临床开发,评估在伴有CMV感染且对当前标准的CMV治疗药物耐药或难治的造血干细胞移植(HSCT)或实体器官移植(SOT)受者中的治疗潜力。目前,maribavir尚未获得任何国家批准。在美国和欧盟,maribavir均已被授予用于高危患者群体治疗临床严重CMV病毒血症以及用于免疫受损患者治疗CMV疾病的孤儿药资格(ODD)。在美国,maribavir还被授予了治疗移植受者CMV感染的突破性药物资格(BTD)。(生物谷Bioon.com)
原文出处:Takeda’s Maribavir P3 Trial Met Primary Endpoint of Superiority to Conventional Antiviral Therapy for Cytomegalovirus
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


