Science子刊解读!揭示坏死性小肠结肠炎中,CD4+ T细胞从肠道迁移到大脑,从而导致大脑损伤
来源:本站原创 2021-01-12 05:24
2021年1月12日讯/生物谷BIOON/---医生们早就知道,作为一种会破坏早产儿的肠道内壁的潜在致命性炎症,坏死性小肠结肠炎(necrotizing enterocolitis, NEC)往往与存活的婴儿出现严重的脑损伤有关。然而,病变的肠道将其破坏性“传达”给新生儿大脑的手段在很大程度上仍然是未知的。如今,在第一项新的研究中,通过研究小鼠,来自美国约翰
2021年1月12日讯/生物谷BIOON/---医生们早就知道,作为一种会破坏早产儿的肠道内壁的潜在致命性炎症,坏死性小肠结肠炎(necrotizing enterocolitis, NEC)往往与存活的婴儿出现严重的大脑损伤有关。然而,病变的肠道将它的破坏性“传达”给新生儿大脑的手段在很大程度上仍然是未知的。
如今,在第一项新的研究中,通过研究小鼠,来自美国约翰霍普金斯大学医学院和瑞士洛桑大学的研究人员鉴定出那个缺失的环节--他们说,免疫系统细胞从肠道迁移到大脑,并攻击那里的细胞,而不是像通常那样保护它们。相关研究结果发表在2021年1月6日的Science Translational Medicine期刊上,论文标题为“Necrotizing enterocolitis induces T lymphocyte–mediated injury in the developing mammalian brain”。
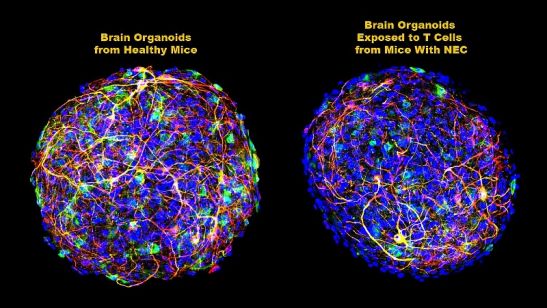
图片来自Science Translational Medicine, 2021, doi:10.1126/scitranslmed.aay6621。
NEC见于多达12%的出生时体重小于3.5磅的婴儿,它是一种快速进展的胃肠急症,其中细菌侵入结肠壁并引起炎症,最终会破坏该部位的健康组织。如果有足够的细胞坏死(死亡),以至于在肠壁上形成了洞,细菌就会进入血液,导致危及生命的败血症。
在2018年的一项小鼠研究中,约翰霍普金斯大学医学院和弗雷德-哈钦森癌症研究中心的研究人员就已发现,患有NEC的动物会产生一种名为TLR4(toll-like receptor 4)的蛋白,这种蛋白会与肠道中的细菌结合并促进肠道破坏。他们还确定TLR4同时激活大脑中称为小胶质细胞的免疫细胞,从而导致白质流失、大脑损伤和认知功能下降。不清楚的是,这两者之间是如何联系起来的。
对于这项新的研究,这些作者推测,CD4+ T淋巴细胞---也被称为辅助性T细胞的免疫系统细胞---可能就是其中的联系。CD4+T细胞之所以被称为 "辅助性",是因为它们帮助另一种叫做B淋巴细胞(即B细胞)的免疫细胞对被细菌或病毒等外来入侵者感染的细胞表面上的抗原作出反应。在CD4+ T细胞受到激活的情形下,未成熟的B细胞要么成为浆细胞,产生抗体来标记被感染的细胞,以便将它们从体内清除,要么成为记忆细胞,“记住”抗原的生物化学特性,以便对未来的入侵做出更快的反应。
CD4+ T细胞也会释放出化学信使,将另一种类型的T细胞(即杀伤性T细胞)招募到该区域,以便清除目标受感染细胞。然而,如果这种活动发生在错误的地方或错误的时间,所释放出的化学信号可能会无意中引导杀伤性T细胞攻击健康细胞。
论文共同通讯作者、约翰霍普金斯大学医学院外科教授、约翰霍普金斯儿童中心外科主治医生David Hackam博士说,“我们通过比较患有NEC的婴儿的大脑和死于其他原因的婴儿的大脑,知道前者有CD4+T细胞的积累,并表现出更多的小胶质细胞活性。我们猜测这些T细胞来自肠道的NEC炎症区域,并开始用新生小鼠作为人类婴儿的模型来证明这一点。”
在一系列实验的第一项实验中,这些作者在幼鼠中诱导了NEC,然后检查了它们的大脑。正如预期的那样,大脑组织中CD4+ T细胞显著增加,以及与小胶质细胞活性增加相关的蛋白水平较高。在后续的测试中,他们发现,患有NEC的小鼠的血脑屏障---通常防止细菌、病毒和其他在血液中循环的有害物质到达中枢神经系统的生物壁---受到削弱。他们推测,这可能解释了来自肠道的CD4+ T细胞如何能够前往大脑。
接下来,这些作者确定积累的CD4+ T细胞是NEC所见大脑损伤的原因。他们首先从生物学上阻止这些辅助性T细胞进入大脑,然后在另一项实验中,通过将这些T细胞与一种特殊设计的抗体结合来中和它们。在这两种情况下,小胶质细胞的活性都被抑制了,大脑中的白质被保留了下来。
为了进一步确定CD4+ T细胞在大脑损伤中的作用,这些作者从患有NEC的小鼠大脑中收集T细胞,并将其注射到同时缺乏T和B淋巴细胞的小鼠大脑中。与没有接受任何T细胞的对照组小鼠相比,接受了这些淋巴细胞的小鼠具有更高水平的招募杀伤性T细胞的化学信号。他们还观察到小胶质细胞的激活、大脑炎症和白质丢失---这些都是大脑损伤的标志物。
然后,这些作者试图更好地确定不断积累的CD4+ T细胞如何破坏白质---实际上是一种叫做髓磷脂的脂肪,它覆盖和保护大脑中的神经元,并促进它们之间的交流。为此,他们使用了大脑类器官,即实验室中生长的小鼠脑细胞用于模拟整个大脑。将患有NEC的小鼠的脑源性CD4+ T细胞添加到这些实验室的大脑类器官中,然后在数周中进行检查。
Hackam和他的同事们发现,随着髓磷脂数量的减少,来自这些T细胞的一种特殊的化学信号---一种称为干扰素-γ(IFN-γ)的细胞因子(炎性蛋白)---在大脑类器官中增加。这种活性未见于添加来自无NEC小鼠的CD4+ T细胞的大脑类器官中。
在将IFN-γ单独添加到大脑类器官中后,这些作者观察到他们在NEC小鼠中观察到的相同增加水平的炎症和髓磷脂减少。当他们加入IFN-γ中和抗体后,这种细胞因子的产生明显减少,炎症得到抑制,白质得到部分恢复。
这些作者得出结论:IFN-γ指导了导致NEC相关大脑损伤的过程。当对患有NEC的小鼠的大脑组织进行检查时,发现IFN-γ的水平高于没有患病的小鼠的大脑组织时,他们的发现得到了证实。 接下来,这些作者研究了CD4+ T细胞是否能从肠道迁移到NEC小鼠的大脑中。为此,他们从有NEC和无NEC的幼鼠肠道中获得了CD4+ T细胞。这两种类型的T细胞都被注射到两组幼鼠的大脑中---一组幼鼠能产生蛋白Rag1,另一组不能产生这种蛋白。Rag1缺失的小鼠没有成熟的T或B淋巴细胞。
Rag1缺失小鼠接受了来自NEC小鼠的肠源性辅助性T细胞,表现出与之前实验中观察到的相同大脑损伤特征。来自有NEC和没有NEC的小鼠的T细胞都没有引起含有Rag1的小鼠的大脑损伤,来自没有NEC的小鼠的T细胞也没有引起Rag1缺失小鼠的大脑损伤。这表明,来自NEC小鼠的肠源性辅助性T细胞是唯一能引起大脑损伤的细胞。
在第二项实验中,将来自有NEC和没有NEC的小鼠的肠源性T细胞注射到Rag1缺失小鼠的腹膜中。只有来自NEC小鼠的肠道T细胞导致大脑损伤。
这一发现通过对NEC小鼠的脑源性和肠源性T淋巴细胞的相同部分进行基因测序得到了证实。有NEC小鼠的脑源性和肠源性辅助性T细胞序列平均有25%的基因相似性,而没有NEC小鼠的脑源性和肠源性辅助性T细胞序列平均只有2%的基因相似性。
在最后一项实验中,这些作者单独阻断了IFN-γ。这对患有重症NEC的小鼠的大脑损伤发生具有显著的保护作用。这些作者说,这表明一种治疗方法可能使患有这种疾病的早产儿受益。
Hackam说,“来自NEC引起炎症的肠道的辅助性T细胞可以迁移到大脑并造成损伤。我们的研究中的小鼠模型之前已经显示出与人类患者中发生的情况非常吻合,因此我们相信这是早产儿NEC相关大脑损伤产生的可能机制。”
基于这些发现,Hackam表示,预防这种类型的大脑损伤的干预措施,包括阻断IFN-γ作用的疗法,是有可能的。
参考资料:
1.Qinjie Zhou et al. Necrotizing enterocolitis induces T lymphocyte–mediated injury in the developing mammalian brain. Science Translational Medicine, 2021, doi:10.1126/scitranslmed.aay6621.
2.Diego F. Niño et al. Cognitive impairments induced by necrotizing enterocolitis can be prevented by inhibiting microglial activation in mouse brain. Science Translational Medicine, 2018, doi:10.1126/scitranslmed.aan0237.
3.Mouse Study Finds Link Between Gut Disease and Brain Injury in Premature Infants
https://www.hopkinsmedicine.org/news/newsroom/news-releases/mouse-study-finds-link-between-gut-disease-and-brain-injury-in-premature-infants
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


