循环内吞体介导的LDL受体运输的分子细胞机制研究获进展
来源:遗传发育所 2020-11-19 12:58
一些膜蛋白或受体通过循环内吞体(recycling endosome)介导,沿微管运输,最终抵达质膜以发挥其生理功能。由于细胞内微管组成的运输网络较复杂,不同货物沿不同的微管运输到不同的目的地,微管轨道之间难免形成交叉。当货物运输到这种交叉点时,可能由于交叉处的空间间隙无法让货物自由通过,货物继续前行将受阻。此时有三种选择,包括变换轨道运输、逆向
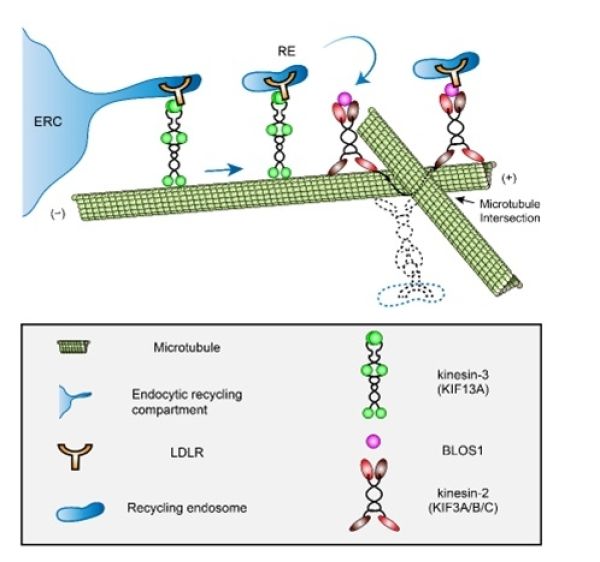
一些膜蛋白或受体通过循环内吞体(recycling endosome)介导,沿微管运输,最终抵达质膜以发挥其生理功能。由于细胞内微管组成的运输网络较复杂,不同货物沿不同的微管运输到不同的目的地,微管轨道之间难免形成交叉。当货物运输到这种交叉点时,可能由于交叉处的空间间隙无法让货物自由通过,货物继续前行将受阻。此时有三种选择,包括变换轨道运输、逆向运输回到起始点、克服路障继续前行,但是变换轨道的运输可能会导致货物被错误地运输到不同的目的地;逆向运输将导致货物无法被正常运到目的地,而在起始点堆积,甚至触发降解机制;克服路障通常需搭载不同的运载工具(动力蛋白)进行接力。微管长程运输中变轨或变换运载工具的分子机制是细胞生物学领域学者关注的问题。
中国科学院遗传与发育生物学研究所研究员税光厚课题组与北京市儿科研究所出生缺陷遗传学研究室教授李巍团队合作,研究循环内吞体介导的LDL受体运输的分子细胞机制,发现BLOS1蛋白处于微管交叉点处,将由kinesin-3正向运输的LDLR转换到kinesin-2的运载工具上,进而克服交叉点形成的路障,使LDLR分子最终被运输到质膜,进而发挥其功能。在BLOS1特异敲除的肝细胞中,研究人员观察到LDLR被逆向运输,继而被溶酶体降解,导致质膜上LDLR缺乏,小鼠血浆中LDL不能及时被肝细胞清除而升高。该研究可能解释了一些高胆固醇血症发生的病理机制。
相关研究成果发表在eLIFE上。实验部分主要由税光厚和李巍共同指导的研究生张昌完成,研究工作得到科技部、国家自然科学基金委和中科院战略性先导科技专项的支持。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


