Science论文深度解读!新研究揭示增强子在动物体内是非常保守的
来源:本站原创 2020-11-14 06:51
2020年11月14日讯/生物谷BIOON/---在一项新的研究中,来自澳大利亚昆士兰大学、新南威尔士大学、莫纳什大学、墨尔本大学、悉尼大学和张任谦心脏研究所的研究人员发现称为增强子的基因调控元件的功能在进化树上分布的动物物种中广泛保守。当他们将来自海绵动物的增强子序列插入斑马鱼和小鼠体内时,这两种脊椎动物都能够解释遗传信息,并驱动发育基因的细胞特异性表达,
2020年11月14日讯/生物谷BIOON/---在一项新的研究中,来自澳大利亚昆士兰大学、新南威尔士大学、莫纳什大学、墨尔本大学、悉尼大学和张任谦心脏研究所的研究人员发现称为增强子的基因调控元件的功能在进化树上分布的动物物种中广泛保守。当他们将来自海绵动物的增强子序列插入斑马鱼和小鼠体内时,这两种脊椎动物都能够解释遗传信息,并驱动发育基因的细胞特异性表达,甚至在海绵动物没有的细胞类型中也是如此。这些研究结果表明至少在某些情况下,增强子的功能在远在7亿年前最后一个共同祖先的物种中持续存在。相关研究结果发表在2020年11月6日的Science期刊上,论文标题为“Deep conservation of the enhancer regulatory code in animals”。
许多增强子位于基因组的非编码区域,Wong称之为“暗物质”部分,这是因为大多数基因组研究都集中在编码蛋白的外显子上。但越来越多的证据表明,人类基因组可能有几十万个增强子,远远超过了我们大约2万个蛋白编码基因。与增强子相互作用的转录因子和增强子所调控的基因相比,增强子的进化也很迅速,这意味着它们可能不会随着时间的推移而保持它们的序列保真度。
因此,通过比对基因组并寻找相似序列来比较它们的传统方法对增强子是无效的,这是因为增强子的短DNA重复序列基序可能会发生很大的变化,以至于它们不再能被识别。事实上,没有一个增强子被证明在整个动物王国中是保守的。
不过,Wong和她的同事们猜测增强子的“调节语法(regulatory grammar)”可能是灵活的,这意味着即使构成增强子的基序的数量、排列或类型发生变动,它们也能保持它们的功能。如果这是真的,增强子理论上可以在不同的物种中保持它们的功能。
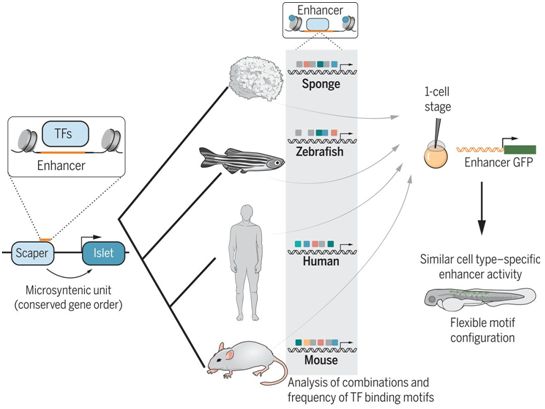
为了检验这一假设,这些研究人员在海绵动物大堡礁海绵(Amphimedon Queenslandica)中寻找推定的增强子,其中大堡礁海绵是一种澳大利亚物种,经常被用来研究后生动物的进化。他们将目标锁定在微同线基因对(microsyntenic gene pair)上,在一个微同线基因对中,一个基因(目标基因)被另一个基因(旁观者)中的增强子所调控。鉴于目标基因通常对正常发育至关重要,他们推断,选择将使得这些基因随着时间的推移变得更加稳定。
虽然这些研究人员发现了60对这样的基因对,但是他们最关注的是一对具有已知调控作用的基因,即Islet-Scaper基因对,其中Islet基因是目标基因,Scaper基因是旁观者。一个称为称为eISL的增强子位于Scaper的内含子上。在脊椎动物中,Islet参与神经系统和心脏发育功能以及其他功能。
这些研究人员首先将整个Islet-Scaper基因对插入到转基因斑马鱼胚胎中,该胚胎仍然含有自身的Islet基因(斑马鱼有三个旁系同源基因)和增强子。如果斑马鱼的调节机制失去了识别这种海绵动物增强子上结合位点的能力,那么他们就不会观察到海绵动物Islet基因的任何表达。然而,Wong和她的同事们除了检测到斑马鱼自身的Islet基因版本外,还检测到了海绵动物Islet基因的转录,这意味着斑马鱼的转录因子即使在经过数亿年的进化后,仍然能够读取这种海绵动物增强子上的结合位点。
接下来,他们将这种海绵动物增强子插入到绿色荧光蛋白(GFP)的上游,其中这种GFP让斑马鱼在这种增强子有活性的特定细胞类型中发光。尽管海绵动物缺乏大脑、眼睛和心脏,但是这种斑马鱼的细胞特异性表达模式与野生型斑马鱼一致,这些发现得到了随后使用小鼠进行的实验的支持。这种源自海绵动物的增强子活性使得斑马鱼在它们的神经系统、耳朵和皮肤中发出最亮的光,而小鼠也在眼睛中表现出GFP表达,这表明即便增强子的序列本身......存在差异,但是存在功能保守性。
Wong说,“当我们把这些增强子序列放到完全不同的在进化上早就分歧开的动物中时,我们观察到它能够驱动细胞类型特异性的表达”,这些发现表明“即使序列本身......存在差异,也存在功能保守性”。
虽然这些研究人员并不是第一个证实序列不需要看起来就能够在动物之间进行转移的研究团队,但是阿根廷布宜诺斯艾利斯大学发育生物学家Flávio S. J. de Souza(未参与这项新的研究)曾研究过增强子和Islet,他对这种保守性的深度感到吃惊。de Souza告诉《科学家》杂志,“我们正在处理一种海绵动物,它位于动物王国系统发育树的最末端。我认为这指向一个更普遍的现象。”
在证明eISL在功能上是保守的之后,Wong接下来开发了一种计算工具,可根据这种增强子结合基序的特征--它们的数量、位置和序列类型,而不是整个序列本身---扫描来自各种数据库中的基因组微同线区域(microsyntenic region),从而在海绵动物、斑马鱼、小鼠和人类中找到这种增强子的同源物。当他们用他们怀疑的人类和小鼠eISL增强子候选同源物构建转基因斑马鱼时,他们发现了类似于他们在早期使用海绵动物eISL版本的实验中观察到的细胞特异性Islet表达模式。
美国加州大学伯克利分校分子生物学家Michael Eisen(未参与这项新的研究)告诉《科学家》杂志,“很明显,这项研究加强了这一点,即它并不要求你将增强子的结合位点保持在相同的位置、相同的数量和相同的定位。你可以用不同的方式来实现相同的输入-输出模式。”
de Souza说,他想知道更多关于Islet增强子在海绵动物本身中的作用。de Souza说,虽然这篇论文已经证明了这部分DNA可以作为增强子发挥作用,但是进行这些转基因实验“使得它脱离了它的天然基因组环境”。更好地理解它在大堡礁海绵中的作用将需要基因组操作,比如在模型生物中常见的基因敲除实验,但在更多的外来物种中做到这一点可能是困难的。
Eisen说,他希望看到这些研究人员对Islet-Scaper基因对持有的同样严谨的态度应用于不同物种中的数百个(如果不是数千个的话)额外的假定增强子。由于对增强子的了解如此之少,很难说他们取得的发现在这些调节元件如何随着时间的推移保持保守性方面是否触及到一个异常值。
Eisen说,“我仍然认为人们没有意识到增强子的进化有多奇怪。定期用新的例子提醒人们是有好处的,这是因为我认为这篇论文描述的现象仍然没有得到广泛的欣赏,即使是转录领域的人。”(生物谷 Bioon.com)
参考资料:
1.Emily S. Wong et al. Deep conservation of the enhancer regulatory code in animals. Science, 2020, doi:10.1126/science.aax8137.
2.Nathan Harmston. Regulation in common: Sponge to zebrafish. Science, 2020, doi:10.1126/science.abe9317.
3.Regulators of Gene Activity in Animals Are Deeply Conserved
https://www.the-scientist.com/news-opinion/regulators-of-gene-activity-in-animals-are-deeply-conserved-68131

Islet增强子的活性在动物进化中是保守的。图片来自Science, 2020, doi:10.1126/science.aax8137。
一旦被蛋白结合,增强子就会控制基因在哪里、何时以及如何受到调控,并在很大程度上负责发育过程中的细胞分化。论文共同通讯作者、张任谦心脏研究所计算基因组学研究员Emily Wong告诉《科学家》杂志,“肌肉细胞之所以与皮肤细胞不同,都是因为基因受到调控的方式不同。这就是为何了解这些区域真地很重要。我们的发现是令人兴奋的,这是因为我们知道这些区域的进化非常迅速,从而使得它们很难找到。”许多增强子位于基因组的非编码区域,Wong称之为“暗物质”部分,这是因为大多数基因组研究都集中在编码蛋白的外显子上。但越来越多的证据表明,人类基因组可能有几十万个增强子,远远超过了我们大约2万个蛋白编码基因。与增强子相互作用的转录因子和增强子所调控的基因相比,增强子的进化也很迅速,这意味着它们可能不会随着时间的推移而保持它们的序列保真度。
因此,通过比对基因组并寻找相似序列来比较它们的传统方法对增强子是无效的,这是因为增强子的短DNA重复序列基序可能会发生很大的变化,以至于它们不再能被识别。事实上,没有一个增强子被证明在整个动物王国中是保守的。
不过,Wong和她的同事们猜测增强子的“调节语法(regulatory grammar)”可能是灵活的,这意味着即使构成增强子的基序的数量、排列或类型发生变动,它们也能保持它们的功能。如果这是真的,增强子理论上可以在不同的物种中保持它们的功能。
为了检验这一假设,这些研究人员在海绵动物大堡礁海绵(Amphimedon Queenslandica)中寻找推定的增强子,其中大堡礁海绵是一种澳大利亚物种,经常被用来研究后生动物的进化。他们将目标锁定在微同线基因对(microsyntenic gene pair)上,在一个微同线基因对中,一个基因(目标基因)被另一个基因(旁观者)中的增强子所调控。鉴于目标基因通常对正常发育至关重要,他们推断,选择将使得这些基因随着时间的推移变得更加稳定。
虽然这些研究人员发现了60对这样的基因对,但是他们最关注的是一对具有已知调控作用的基因,即Islet-Scaper基因对,其中Islet基因是目标基因,Scaper基因是旁观者。一个称为称为eISL的增强子位于Scaper的内含子上。在脊椎动物中,Islet参与神经系统和心脏发育功能以及其他功能。
这些研究人员首先将整个Islet-Scaper基因对插入到转基因斑马鱼胚胎中,该胚胎仍然含有自身的Islet基因(斑马鱼有三个旁系同源基因)和增强子。如果斑马鱼的调节机制失去了识别这种海绵动物增强子上结合位点的能力,那么他们就不会观察到海绵动物Islet基因的任何表达。然而,Wong和她的同事们除了检测到斑马鱼自身的Islet基因版本外,还检测到了海绵动物Islet基因的转录,这意味着斑马鱼的转录因子即使在经过数亿年的进化后,仍然能够读取这种海绵动物增强子上的结合位点。
接下来,他们将这种海绵动物增强子插入到绿色荧光蛋白(GFP)的上游,其中这种GFP让斑马鱼在这种增强子有活性的特定细胞类型中发光。尽管海绵动物缺乏大脑、眼睛和心脏,但是这种斑马鱼的细胞特异性表达模式与野生型斑马鱼一致,这些发现得到了随后使用小鼠进行的实验的支持。这种源自海绵动物的增强子活性使得斑马鱼在它们的神经系统、耳朵和皮肤中发出最亮的光,而小鼠也在眼睛中表现出GFP表达,这表明即便增强子的序列本身......存在差异,但是存在功能保守性。
Wong说,“当我们把这些增强子序列放到完全不同的在进化上早就分歧开的动物中时,我们观察到它能够驱动细胞类型特异性的表达”,这些发现表明“即使序列本身......存在差异,也存在功能保守性”。
虽然这些研究人员并不是第一个证实序列不需要看起来就能够在动物之间进行转移的研究团队,但是阿根廷布宜诺斯艾利斯大学发育生物学家Flávio S. J. de Souza(未参与这项新的研究)曾研究过增强子和Islet,他对这种保守性的深度感到吃惊。de Souza告诉《科学家》杂志,“我们正在处理一种海绵动物,它位于动物王国系统发育树的最末端。我认为这指向一个更普遍的现象。”
在证明eISL在功能上是保守的之后,Wong接下来开发了一种计算工具,可根据这种增强子结合基序的特征--它们的数量、位置和序列类型,而不是整个序列本身---扫描来自各种数据库中的基因组微同线区域(microsyntenic region),从而在海绵动物、斑马鱼、小鼠和人类中找到这种增强子的同源物。当他们用他们怀疑的人类和小鼠eISL增强子候选同源物构建转基因斑马鱼时,他们发现了类似于他们在早期使用海绵动物eISL版本的实验中观察到的细胞特异性Islet表达模式。
美国加州大学伯克利分校分子生物学家Michael Eisen(未参与这项新的研究)告诉《科学家》杂志,“很明显,这项研究加强了这一点,即它并不要求你将增强子的结合位点保持在相同的位置、相同的数量和相同的定位。你可以用不同的方式来实现相同的输入-输出模式。”
de Souza说,他想知道更多关于Islet增强子在海绵动物本身中的作用。de Souza说,虽然这篇论文已经证明了这部分DNA可以作为增强子发挥作用,但是进行这些转基因实验“使得它脱离了它的天然基因组环境”。更好地理解它在大堡礁海绵中的作用将需要基因组操作,比如在模型生物中常见的基因敲除实验,但在更多的外来物种中做到这一点可能是困难的。
Eisen说,他希望看到这些研究人员对Islet-Scaper基因对持有的同样严谨的态度应用于不同物种中的数百个(如果不是数千个的话)额外的假定增强子。由于对增强子的了解如此之少,很难说他们取得的发现在这些调节元件如何随着时间的推移保持保守性方面是否触及到一个异常值。
Eisen说,“我仍然认为人们没有意识到增强子的进化有多奇怪。定期用新的例子提醒人们是有好处的,这是因为我认为这篇论文描述的现象仍然没有得到广泛的欣赏,即使是转录领域的人。”(生物谷 Bioon.com)
参考资料:
1.Emily S. Wong et al. Deep conservation of the enhancer regulatory code in animals. Science, 2020, doi:10.1126/science.aax8137.
2.Nathan Harmston. Regulation in common: Sponge to zebrafish. Science, 2020, doi:10.1126/science.abe9317.
3.Regulators of Gene Activity in Animals Are Deeply Conserved
https://www.the-scientist.com/news-opinion/regulators-of-gene-activity-in-animals-are-deeply-conserved-68131
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


