Nature:外泌体能够抵御细菌毒素,对抗超级细菌感染
来源:BioArt 2020-11-09 21:28
耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)又称“超级细菌”,是1961年首先在英国发现的一类感染性革兰氏阳性致病菌。最开始MRSA的传播仅限于医院内感染免疫缺陷患者等易感人群,目前MRSA已发展出社区传播趋势,导致健康非易感人群个体的感染甚至死亡【1】。MRSA的危害性主要源于
耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)又称“超级细菌”,是1961年首先在英国发现的一类感染性革兰氏阳性致病菌。最开始MRSA的传播仅限于医院内感染免疫缺陷患者等易感人群,目前MRSA已发展出社区传播趋势,导致健康非易感人群个体的感染甚至死亡【1】。MRSA的危害性主要源于其能够分泌成孔毒素破坏宿主的细胞膜结构,引起细胞膨胀和溶解,最终导致细胞功能丧失甚至坏死,给宿主带来致命伤害。MRSA导致的严重感染是全球公共健康的巨大威胁,因此开发针对MRSA等严重病原菌的治疗策略是目前亟待解决的科学问题。
近日,来自纽约大学朗格尼健康中心的Victor J. Torres和Ken Cadwell教授合作在Nature发表了题为“Decoy exosomes provide protection against bacterial toxins”的研究论文,该研究揭示了ATG蛋白能够促进外泌体的释放,进而在体外结合多种病原毒素,协助宿主抵御病原菌的感染。
先前有研究表明从小鼠中获得的表达自噬蛋白Atg16l1的原代细胞,在α-毒素存在的情况下,金属蛋白酶ADAM10总体表达水平增加且细胞更容易发生裂解【2】。与之一致的是,作者发现,ATG16L1敲除后,人肺泡上皮细胞系A549的细胞表面以及总体ADAM10的表达水平均上升。用α-毒素处理ATG16L1敲除型细胞后,细胞死亡率上升,而ADAM10敲除型细胞则具有抵抗性。ATG16L1介导的磷脂酰乙醇胺与泛素样分子LC3的结合对自噬体生物发生以及随后的溶酶体降解底物必不可少【3】。抑制ATG16L1的结合因子ULK1(ATG16L1或ATG5上游激酶),细胞表面的ADAM10水平与ATG16L1敲除型细胞的表达水平一致,均有增加。
用溶酶体酸化抑制剂处理A549细胞,改变内吞体至细胞膜的运输循环后,总ADAM10以及自噬底物SQSTM1的表达水平增加,细胞表面的ADAM10表达水平则降低,而上皮细胞黏附分子(EpCAM)的膜表面ADAM10表达水平没有改变,表明溶酶体抑制剂不能影响所有的细胞膜表面分子的表达,ADAM10表达水平改变与溶酶体途径无关。同时,蛋白酶体抑制剂处理也不能影响ADAM10的表达水平。以上结果表明,ATG蛋白降低细胞表面ADAM10的表达水平是通过独立于溶酶体以及蛋白酶体途径进行的。
ATG蛋白可以通过分泌性自噬的方式介导可溶性以及囊泡结合底物的胞外释放【4】,ADAM10则通常能够整合到外泌体——直径为40 - 120nm的细胞外囊泡中【5】。因此作者推测,ATG蛋白可以通过自噬途径促进外泌体的释放从而抑制ADAM10的积累。通过分离ATG16L1敲除型细胞培养上清中的外泌体,作者发现低分子量的ADAM10水平减少。通过免疫印迹、透射电镜以及流式细胞分析表明ATG16L1敲除型细胞培养上清中,外泌体标志物CD9水平降低,外泌体中囊泡数量下降。
敲除自噬蛋白能显着降低培养上清中外泌体的总数,而敲除ATG16L1则能够降低ADAM10阳性的外泌体总数而非单个外泌体中ADAM10的含量。这些结果表明ATG蛋白能够调控外泌体的生物发生,而非与底物的结合。随后,作者敲除分泌性自噬途径中介导自噬体-溶酶体融合的关键蛋白STX17,发现ADAM10的表面表达水平并没有升高,而外泌体含量增加,表明ATG蛋白介导的外泌体释放是通过一种不同于传统自噬降解的方式进行。
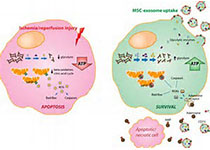
为进一步探究病原与ATG依赖性外泌体产生之间的关系,作者以Heat-killed S. aureus(HKSA)、肺炎链球菌(Streptococcus pneumoniae)、鼠柠檬酸杆菌(Citrobacter rodentium)和鼠伤寒沙门氏菌(Salmonella enterica Typhimurium)为研究对象,发现这些病原菌可以促进人和小鼠细胞中外泌体的产生,细菌的DNA和CpG DNA能够作为外泌体的诱导物,且这一过程依赖于内吞DNA感应器——Toll样受体9(TLR9)。通过抑制多泡体(MVB)的出芽来阻止囊泡与外泌体的转换后,CpG DNA介导的外泌体产生过程受到了抑制。以上结果表明,TLR9下游的膜运输可能是通过调控内吞体运输和包括MVB在内的囊泡生物发生的方式,促进了外泌体的产生。
随后,作者探究了释放的囊泡是否能够结合毒素并抑制毒性,发现外泌体、HKSA或CpG DNA均能够保护宿主并抵抗α-毒素,且外泌体是通过在外泌体膜上诱导毒素的寡聚化从而保护细胞的。此外,作者还发现外泌体还能保护细胞并抵御白喉毒素,表明外泌体能够中和多种类型的毒素。为探究外泌体在体内的保护作用,作者将HKSA注射小鼠以诱导外泌体在血液中产生,发现与Atg16l1敲除型小鼠来源的外泌体相比,野生型小鼠来源的外泌体显着增加了感染S. aureus野生型小鼠的生存率,表明外泌体同样能够在体内条件下中和细菌毒素并抵御病原感染。
综上所述,该研究为深入理解外泌体的功能提供了全新视角,揭示了外泌体在先天免疫反应中的新功能,即抵御病原菌感染,中和膜表面的成孔毒素等毒力因子,且ATG蛋白能够在宿主防御病原感染时,促进外泌体的产生。鉴于胞外囊泡的起源和调控机制并未完全清楚,该研究对理解细胞响应感染并激发防御体产生的过程提供了更为详尽的认知,并为开发新的针对病原菌感染的治疗策略提供了潜在方案。(生物谷Bioon.com)
小编推荐会议 2020(第五届)外泌体与疾病研讨会
http://meeting.bioon.com/2020Exosomes?__token=liaodefeng
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


