针对新冠病毒SARS-CoV-2/COVID-19,Science期刊研究进展一览(第5期)
来源:本站原创 2020-09-30 23:58
2020年9月30日讯/生物谷BIOON/---自2019年12月8日以来,中国湖北省武汉市报告了几例病因不明的肺炎。大多数患者在当地的华南海鲜批发市场工作或附近居住。在这种肺炎的早期阶段,严重的急性呼吸道感染症状出现了,一些患者迅速发展为急性呼吸窘迫综合征 (acute respiratory distress syndrome, ARDS)、急性呼吸衰竭
2020年9月30日讯/生物谷BIOON/---自2019年12月8日以来,中国湖北省武汉市报告了几例病因不明的肺炎。大多数患者在当地的华南海鲜批发市场工作或附近居住。在这种肺炎的早期阶段,严重的急性呼吸道感染症状出现了,一些患者迅速发展为急性呼吸窘迫综合征 (acute respiratory distress syndrome, ARDS)、急性呼吸衰竭和其他的严重并发症。2020年1月7日,中国疾病预防控制中心(China CDC)从患者的咽拭子样本中鉴定出一种新型冠状病毒,最初被世界卫生组织(WHO)命名为2019-nCoV。大多数2019-nCoV肺炎患者的 症状较轻,预后良好。到目前为止,一些患者已经出现严重的肺炎,肺水肿,ARDS或多器官功能衰竭和死亡。
2020年2月11日,世卫组织将这种疾病病重命名为2019年冠状病毒病(COVID-19)。同一天,负责分类和命名病毒的的国际病毒分类学委员会的冠状病毒研究小组在bioRxiv上发表了一篇文章,指出该研究小组已经决定,新型冠状病毒2019-nCoV是导致2002-2003年爆发严 重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)的变种。因此,将这种新病原体重新命名为严重急性呼吸综合征冠状病毒2号(severe acute respiratory syndrome coronavirus 2),或SARS-CoV-2。值得注意的一点是,尽管国际病毒分类委员会冠状病毒研究小组将 病毒命名为SARS-CoV-2,但该研究小组主席John Ziebuhr认为这个名字(SARS-CoV-2)和SARS(严重急性呼吸综合征,也称非典型肺炎)没有关联。不过,这种病毒的重新命名引起了不少争议。据《科学》网站报道,世界卫生组织不满意SARS-CoV-2这个名字,而且不打 算采用此名称。
冠状病毒可引起多种动物的多系统感染。在此之前已有6种冠状病毒可以感染人类,它们主要引起人类的呼吸道感染:两种高度致命性的冠状病毒,即严重急性呼吸道综合征(SARS)冠状病毒(SARS-CoV)和中东呼吸综合征(MERS)冠状病毒(MERS-CoV);4种可导致温 和的上呼吸道疾病的冠状病毒,即HCoV-OC43、HCoV-229E、HCoV-NL63和HCoV-HKU1。
1.Science:深入分析人体对新冠病毒的抗体反应,为开发新的更有效疫苗奠定基础
doi:10.1126/science.abd4250
一种旨在从一滴血中检测病毒感染史的工具在COVID-19时代得到了升级。VirScan是一种可以确定1000多种不同病毒中哪些病毒感染过人的技术,如今还可以检测出包括SARS-CoV-2在内的冠状病毒的感染证据。在一项新的研究中,来自美国布莱根妇女医院和哈佛医学院的研究人员提供了大量关于人类对SARS-CoV-2的抗体反应的细节,以及这种反应在感染了更严重的COVID-19的个体中可能有什么不同。相关研究结果于2020年9月29日在线发表在Science期刊上,论文标题为“Viral epitope profiling of COVID-19 patients reveals cross-reactivity and correlates of severity”。

在分析中,Elledge及其同事们通过使用VirScan分析了232名COVID-19患者和190名对照者在COVID-19出现前的血液样本,深入研究了对SARS CoV-2的抗体反应。他们确定了免疫系统可以识别的800个称为表位(epitope)的病毒位点。并非所有的表位都是一样的,有些表位可能被中和抗体识别,从而引起消除感染的反应。然而,如果身体产生了针对其他表位的抗体,它可能会启动一个不太有效的反应,从而让这种病毒占据优势。在某些情况下,包括SARS-CoV病毒在内的病毒甚至能够从身体的抗体反应中获益,利用抗体进入细胞,这种现象被称为抗体依赖性增强作用(antibody-dependent enhancement)。
就SARS-CoV-2而言,Elledge团队检测到了一系列针对不同表位的抗体频率。许多表位是公共表位(public epitope)---被大量患者的免疫系统识别的区域。其中的一个公共表位被79%的COVID-19患者识别。其他的表位被认为是私有的,只被少数人甚至一个人的免疫系统识别。10个表位存在于这种病毒进入宿主细胞所必需的关键区域,可能被中和抗体识别。该团队利用最具鉴别力的表位开发了一种快速 诊断测试方法。
2.两篇Science揭示一些重症COVID-19病例与基因突变或攻击人体的自身抗体有关
doi:10.1126/science.abd4570; doi:10.1126/science.abd4585
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。被新型冠状病毒SARS-CoV-2感染的人可能会出现从轻度到致命的症状。如今,两项新的研究表明一些威胁生命的病例可以追溯到患者免疫系统的薄弱环节。
在患有重症COVID-19的患者中,至少有3.5%的人的抗病毒防御基因存在突变。至少有10%的重症患者会产生攻击免疫系统而不是与病毒抗争的“自身抗体”。这些发现确定了危及生命的COVID-19的某些根本原因。相关研究结果以两篇论文的形式于2020年9月24日在线发表在Science期刊上,论文标题分别为“Inborn errors of type I IFN immunity in patients with life-threatening COVID-19”和“Auto-antibodies against type I IFNs in patients with life-threatening COVID-19”。
这两篇论文的通讯作者、美国洛克菲勒大学研究员Jean-Laurent Casanova说,在这么多患者中(987名患者中的101人)观察到这些有害抗体是“令人吃惊的发现”。“这两篇论文首次解释了为何COVID-19在某些人中如此严重,而其他大多数被同一病毒感染的人则不会如此。”
3.Science:超强效抗体混合物阻断新冠病毒附着宿主细胞
doi:10.1126/science.abe3354
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。在一项新的研究中,来自美国、法国、比利时和意大利的研究人员发现来自康复的COVID-19患者的超强效抗体(ultrapotent antibody)混合物可识别和封锁这种大流行冠状病毒的感染复合体(infection machinery),并阻止它进入细胞。每种类型的超强效抗体发挥的作用存在重叠,但是也略有不同。低剂量的这些超强效抗体,不管是单独使用还是混合在一起使用,都可以阻止SARS-CoV-2在肺部中复制,因而保护仓鼠在暴露于这种病毒时免受感染。相关研究结果于2020年9月24日在线发表在Science期刊上,论文标题为“Ultrapotent human antibodies protect against SARS-CoV-2 challenge via multiple mechanisms”。
这种抗体混合物的一个优点是,它们也可能防止在这次大流行期间这种冠状病毒出现的自然突变体形式逃避治疗。由于在这次冠状病毒大流行期间已在它的感染复合体中发现了一些突变体,使用抗体混合物可以中和一系列这样的病毒突变体。
4.Science:发现新冠病毒S蛋白的一个亚油酸结合口袋,为开发阻止这种病毒感染的药物奠定基础
doi:10.1126/science.abd3255
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。在一项新的研究中,来自英国布里斯托大学等研究机构的研究人员发现SARS-CoV-2刺突蛋白(S蛋白)中的一个可用于阻止这种冠状病毒感染人体细胞的药物可靶向口袋(druggable pocket,即这个S蛋白中的口袋可通过药物进行靶向结合)。他们表示,这些发现可能有助于战胜当前的COVID-19流行病,而且靶向这个新发现的口袋的小分子抗病毒药物可能有助于消除这种疾病。相关研究结果于2020年9月21日在线发表在Science期刊上,论文标题为“Free fatty acid binding pocket in the locked structure of SARS-CoV-2 spike protein”。论文通讯作者为布里斯托大学的Christiane Schaffitzel教授和马克斯-普朗克布里斯托最小生物学中心的Imre Berger教授。
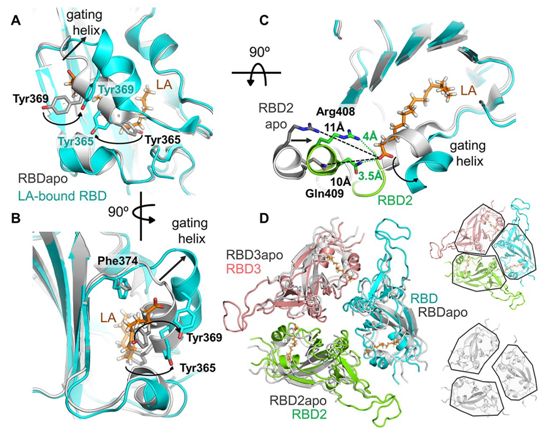
在这项突破性的研究中,这些研究人员使用了一种强大的成像技术--电子低温显微镜(cryo-EM),以近原子分辨率分析了SARS-CoV-2 S蛋白。在甲骨文公司(Oracle)高性能云计算的支持下,他们生成了SARS-CoV-2 S蛋白的三维结构,这样他们能够深入到S蛋白的内部,从而识别它的分子组成。
出乎意料的是,这些研究人员的分析发现在S蛋白内的一个特制的口袋里,埋藏着一个小分子---亚油酸(LA)。LA是一种游离脂肪酸,是许多细胞功能不可或缺的物质。人体不能产生LA。相反,身体通过饮食吸收这种必需的分子。耐人寻味的是,LA在炎症和免疫调节中起着至关重要的作用,而这两者都是COVID-19疾病进展的关键因素。LA还能够维持肺部中的细胞膜,以便我们能够正常呼吸。
5.Science:长期感染新冠病毒对免疫系统的长期有效反应产生影响
doi:10.1126/science.abd7343
新研究表明,自然免疫和疫苗诱导的免疫力将成为影响全球冠状病毒大流行(COVID-19)未来发展轨迹的关键因素。普林斯顿大学研究人员做出的这项研究成果最近发表在《Science》杂志上。研究表明,开发一种能够引起强烈免疫反应的疫苗可以大大减少未来的感染负担。
文章共同第一作者Chadi Saad-Roy说:“到目前为止,与COVID-19的未来发展轨迹有关的讨论都正确地集中在季节性和非药物干预的影响上,例如,戴口罩和社交隔离。从短期来看,在大流行阶段,非传染性疾病是决定病例负担的关键因素。但是,随着我们对未来的展望,免疫的作用将变得越来越重要。”
6.Science:揭示SARS-CoV-2在欧洲和北美的传播
doi:10.1126/science.abc8169
在一项新的研究中,来自美国、英国、加拿大和比利时的研究人员将来自冠状病毒样本的进化基因组学数据与计算机模拟的流行病学数据和详细的旅行记录相结合,以前所未有的细节重建冠状病毒SARS-CoV-2在世界各地的传播。相关研究结果于2020年9月10日在线发表在Science期刊上,论文标题为“The emergence of SARS-CoV-2 in Europe and North America”。这些研究结果表明,在加强检测和接触者追踪可能阻止SARS-CoV-2在北美和欧洲建立的过程中,一个长时间的机会期错过了。
这篇论文还挑战了将今年1月份各大洲最早的已知COVID-19病例与数周后检测到的疫情爆发联系起来的建议,并提供了有价值的见解,可以为公共卫生响应提供信息,并有助于预测和预防未来COVID-19和其他人畜共患病的爆发。
论文共同通讯作者、亚利桑那大学研究员Michael Worobey说,“我们的愿望是开发和应用强大的新技术,在全球范围内对疫情如何在空间和时间上传播进行明确的分析。在此之前,科学、社交媒体和数量空前的等着同行评审的预印本文章的大杂烩中充斥着各种各样的可能性。”
7.Science:揭示新冠病毒在美国华盛顿州的隐性传播
doi:10.1126/science.abc0523
对SARS-CoV-2的基因组测序可以重建它的传播历史,不过这取决于采样情况。在一项新的研究中,来自美国多家研究机构的研究人员分析了2020年2月20日至3月15日期间从来自美国华盛顿州的感染患者体内收集的453个SARS-CoV-2基因组。他们发现,在此期间采样的大多数SARS-CoV-2感染源于2020年1月底或2月初的一次病毒输入,随后这种病毒在实施积极的社区监测之前在当地传播。相关研究结果近期发表在Science期刊上,论文标题为“Cryptic transmission of SARS-CoV-2 in Washington state”。

这些结果突出表明,即使在当前疫情得到控制之后,仍有必要在美国和世界其他地区广泛监测SARS-CoV-2的社区传播。疾病严重程度的广泛性使得监测工作面临挑战。传统的公共卫生监测和基因组流行病学的结合可以提供可操作的新见解,就像这项研究中提及的那样:在2020年2月29日对最初的社区病例进行测序后,结果立即与美国国家、州和地方公共卫生部门分享,从而在西雅图市和华盛顿州掌握现有的COVID-19传播范围时迅速推出社会隔离政策。西雅图当地传播的确认促使检测标准发生变化,以着重关注没有旅行史的个人。从2月29日起,新的基因组数据立即发布到GISAID EpiCoV序列数据库,并通过Nextstrain在线平台与其他公开的SARS-CoV-2基因组一起进行分析,以提供即时和公众的形势意识。这些研究人员认为,社区监测、基因组分析和公众实时分享结果的结合,将增强传染病监测新系统的能力。
8.Science:计算机设计的小蛋白可高效抑制新冠病毒感染
doi:10.1126/science.abd9909
SARS-CoV-2是导致新冠肺炎(COVID-19)的冠状病毒。在一项新的研究中,来自美国华盛顿大学和乔治亚大学的研究人员发现计算机设计的小蛋白(miniprotein)可以保护实验室培养的人细胞免受SARS-CoV-2感染。相关研究结果于2020年9月9日在线发表在Science期刊上,论文标题为“De novo design of picomolar SARS-CoV-2 miniprotein inhibitors”。
在实验中,一种被命名为LCB1的主要抗病毒候选药物在保护作用上可与最著名的SARS-CoV-2中和抗体相媲美。LCB1目前正在啮齿动物中进行评估。
9.Science:揭示基因CIITA诱导人细胞抵抗埃博拉病毒和SARS样冠状病毒感染机制
doi:10.1126/science.abb3753
在一项新的研究中,来自美国弗吉尼亚梅森大学贝纳罗亚研究所、凯斯西储大学、波士顿大学医学院和MRIGlobal公司的研究人员发现了一种新的细胞保护途径,该途径靶向几种不同大流行病毒中的共同弱点。他们发现这种途径可以保护细胞免受埃博拉病毒和诸如SARS-CoV-2之类的冠状病毒感染。这些新发现使得人们更好地理解参与抵抗病毒感染的细胞机制,从而为治疗未来病毒性传染病提供参考。相关研究结果于2020年8月27日在线发表在Science期刊上,论文标题为“MHC class II transactivator CIITA induces cell resistance to Ebola virus and SARS-like coronaviruses”。
这项研究阐明了所发现的两个基因的全新作用,以及抑制病毒融合和进入人体细胞的独特方法,这使得我们离下一代抗病毒疗法更近了一步。这些研究人员利用转座子介导的基因激活筛选方法,寻找可以阻止埃博拉病毒感染的新基因。
这种新的筛选策略可作为发现针对其他危险病原体的抵抗机制的蓝本。利用这种策略,这些研究人员发现了基因CIITA(MHC class II transactivator,MHCII类反式激活蛋白)通过激活第二个基因CD74的表达,诱导人细胞系产生抵抗力。作为CD74的一种形式,p41破坏了称为组织蛋白酶(Cathepsin)的细胞蛋白酶对埃博拉病毒蛋白外壳上的蛋白的加工。这可以阻止这种病毒进入细胞和感染。p41还会阻断包括SARS-CoV-2在内的冠状病毒的组织蛋白酶依赖性进入途径。
10.Science:针对刺突蛋白的新发现揭示了新冠病毒感染人细胞的能力
doi:10.1126/science.abd5223
在SARS-CoV-2感染初期,这种病毒利用它的表面上的刺突蛋白(S蛋白)附着到人体细胞上。S蛋白是疫苗研发的核心,这是因为它能触发人体免疫反应。在一项新的研究中,来自德国马克斯-普朗克生物物理学研究所(MPI)、欧洲分子生物学实验室(EMBL)、保罗-埃里希研究院(Paul-Ehrlich-Institut,PEI)和法兰克福歌德大学等研究机构的研究人员着重关注这种病毒的表面结构,以获得可用于开发疫苗和治疗感染患者的有效疗法的新见解。相关研究结果于2020年8月18日在线发表在Science期刊上,论文标题为“In situ structural analysis of SARS-CoV-2 spike reveals flexibility mediated by three hinges”。
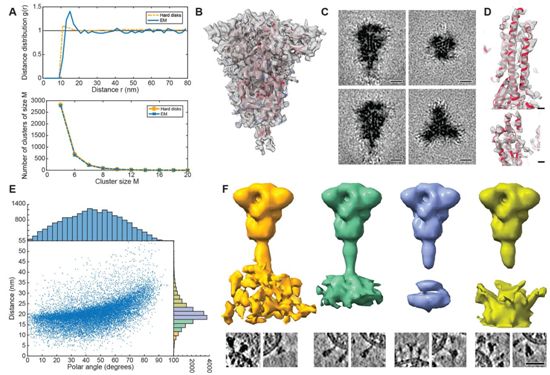
这些作者结合低温电子断层扫描(cryo-electron tomography, cryo-ET)、子断层扫描图平均化(subtomogram averaging)和分子动力学模拟,在近原子分辨率下分析了S蛋白在它的自然环境中、完整病毒颗粒上的分子结构。利用EMBL最先进的低温电镜成像设备,他们生成了大约1000个SARS-CoV-2病毒的266幅低温电子断层扫描图,每个病毒表面平均携带40个S蛋白刺突。子断层扫描图平均化和图像处理,再结合分子动力学模拟,最终提供了关于这些S蛋白刺突的重要和新的结构信息。
这些结果令人吃惊:他们的数据显示,S蛋白的球状部分,包含受体结合区域和与靶细胞融合所需的区域,而且这个球状部分连接到一个柔性的茎区域。论文共同通讯作者、EMBL小组负责人、MPI主任Martin Beck解释道,“S蛋白刺突的上部球状部分具有用于疫苗开发的重组蛋白很好重现的结构。然而,我们关于茎区域将S蛋白的球状部分固定在病毒表面上的发现是新的。”
11.Science:揭示重症COVID-19患者出现免疫系统瘫痪
doi:10.1126/science.abc6261
在一项新的研究中,来自美国斯坦福大学、埃默里大学和中国香港大学、香港医院管理局的研究人员发现在病情严重的COVID-19患者中,应当对体内病毒或细菌的迹象立即做出反应的“第一反应者” 免疫细胞反应迟钝。相关研究结果于2020年8月11日在线发表在Science期刊上,论文标题为“Systems biological assessment of immunity to mild versus severe COVID-19 infection in humans”。
有些人因COVID-19而真正生病,而有些人却没有。没有人知道为什么。如今,在这项研究中,这些作者发现了 免疫学上的偏差和失误似乎可以区分重度和轻度的COVID-19病例之间的差异。
这种差异可能源于我们进化上古老的先天免疫系统如何应对SARS-CoV-2,即导致COVID-19的冠状病毒。从果蝇到人类的所有生物中都有先天免疫系统,它能迅速感知病毒和其他病原体。一旦它感知到,它就会立即对它们发起一种不加区分的攻击,并调动更精确靶向的但行动缓慢的“神枪手”细胞,它们属于人体病原体防御力量的另一个分支---适应性免疫系统。
论文通讯作者、斯坦福大学医学院病理学教授、微生物学与免疫学教授Bali Pulendran博士说,“这些发现揭示了免疫系统如何在冠状病毒感染期间出错而导致严重的疾病,并指出了潜在的治疗靶标。”论文第一作者为斯坦福大学博士后学者Prabhu Arnunachalam博士、Florian Wimmers博士以及香港大学公共卫生实验室科学助理教授Chris Ka Pun Mok博士和Mahen Perera博士。
12.Science:重磅!鉴定出横跨冠状病毒双膜囊泡的分子孔
doi:10.1126/science.abd3629; doi:10.1126/science.abe0322
在一项新的研究中,来自荷兰莱顿大学医疗中心、德国莱布尼茨实验病毒学研究所、汉堡大学和美国加州大学旧金山分校的研究人员通过可视化观察冠状病毒在受感染的宿主细胞中的复制,可能解答了一个长期存在的问题,即新合成的冠状病毒组分如何能够被整合到具有完全传染性的病毒中。相关研究结果于2020年8月6日在线发表在Science期刊上,论文标题为“A molecular pore spans the double membrane of the coronavirus replication organelle”。论文通讯作者为莱顿大学医疗中心的Montserrat Bárcena。论文第一作者为莱顿大学医疗中心的Georg Wolff。
冠状病毒在宿主细胞的细胞质中复制它们的庞大基因组。它们通过将宿主细胞膜转化为奇特的双膜囊泡(double-membrane vesicle, DMV)来实现这一点。新制造的病毒RNA需要从这些DMV输出到细胞质中,才能被包装成完整的、具有传染性的冠状病毒。然而,到目前为止,在DMV复制区室中还没有检测到通往细胞质的开口。
在这项新的研究中,为了寻求了解病毒RNA如何从封闭的DMA中运输出去,这些研究人员利用电子断层成像技术可视化观察小鼠肝炎冠状病毒(mouse hepatitis coronavirus)感染宿主细胞的中间阶段,由于原位低温电镜研究的生物安全限制,他们使用小鼠肝炎冠状病毒来代替SARS-CoV-2。
他们鉴定出一种冠状病毒特异性的冠状结构--跨越DMV两层膜的分子孔,它可能在RNA从DMV复制区室中释放出来的过程中发挥作用。在使用SARS-CoV-2感染细胞的预固定样本的进一步研究工作中,他们发现这种结构也存在于SARS-CoV-2诱导的DMV中。
13.Science:利用经过基因改造的人ACE受体作为诱饵引诱新冠病毒,阻断感染
doi:10.1126/science.abc0870; doi:10.1126/science.abe0010
在一项新的研究中,来自美国伊利诺伊大学香槟分校等研究机构的研究人员指出利用诱饵受体(decoy receptor)---一种经过改造的自由漂浮的受体蛋白---引诱SARS-CoV-2,这样这种诱饵受体就可结合这种病毒并阻止感染。相关研究结果于2020年8月4日在线发表在Science期刊上,论文标题为“Engineering human ACE2 to optimize binding to the spike protein of SARS coronavirus 2”。论文通讯作者为伊利诺伊大学香槟分校的的生物化学教授Erik Procko博士。
要感染人类细胞,病毒必须首先与细胞表面的受体蛋白结合。SARS-CoV-2是导致COVID-19的冠状病毒,它与一种名为ACE2的受体结合。ACE2在调节血压、血容量和炎症方面发挥着多种作用。它存在于全身组织中,特别是在肺部、心脏、动脉、肾脏和肠道中。科学家们推测,与COVID-19相关的一系列症状可能源于这种冠状病毒与ACE2结合并使得后者无法执行它的正常功能。
Procko说,“给予基于ACE2的诱饵受体可能不仅可以中和感染,而且还可能具有拯救失去的ACE2活性和直接治疗COVID-19方面的额外好处。”
14.Science:震惊!暴露于普通感冒冠状病毒可以教会人体免疫系统识别SARS-CoV-2
doi:10.1126/science.abd3871
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。在一项新的研究中,来自美国拉霍亚 免疫学研究所、北卡罗莱纳大学医学院、加州大学圣地亚哥分校和澳大利亚莫道克大学的研究人员发现识别普通感冒冠状病毒的记忆辅助性T细胞也能识别SARS-CoV-2上的匹配位点。相关研究结果于2020年8月4日在线发表在Science期刊上,论文标题为“Selective and cross-reactive SARS-CoV-2 T cell epitopes in unexposed humans”。
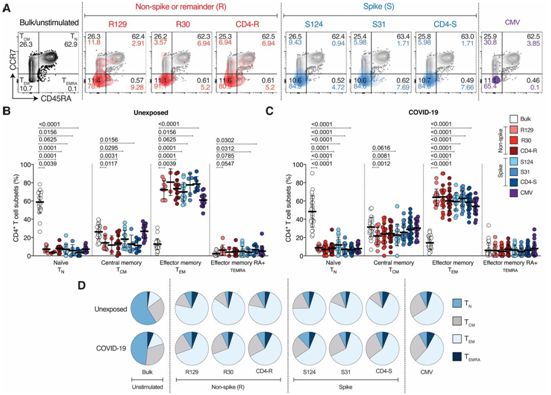
论文共同通讯作者、拉霍亚免疫学研究所研究助理教授Daniela Weiskopf博士,“我们如今证明,在一些人中,预先存在的针对普通感冒冠状病毒的T细胞记忆可以交叉识别SARS-CoV-2,甚至可以精确到分子结构上。这可能有助于解释为什么有些人表现出较轻的疾病症状,而另一些人则会严重生病。”
15.Science:详解我国科学家开发出适应小鼠的SARS-CoV-2毒株,可用于测试疫苗疗效
doi:10.1126/science.abc4730
在一项新的研究中,中国军事医学科学院微生物流行病研究所的孙世惠(Shihui Sun)、秦成峰(Cheng-Feng Qin)和周育森(Yusen Zhou, 已故)以及复旦大学病原微生物研究所的姜世勃(Shibo Jiang)等人开发出一种适应小鼠的SARS-CoV-2毒株,它能够在呼吸道中高效复制,并且在有免疫活性的野生型小鼠中引起间质性肺炎。此外,他们还在用这种SARS-CoV-2毒株进行挑战的小鼠模型中测试了一种新开发的重组亚单位候选疫苗的保护效果。相关研究结果于2020年7月30日在线发表在Science期刊上,论文标题为“Adaptation of SARS-CoV-2 in BALB/c mice for testing vaccine efficacy”。
在这项新的研究中,这些研究人员并不采取对小鼠进行基因改造使之表达人ACE2的方法,相反,他们采取了一种新的策略:他们对在临床上观察到的一种SARS-CoV-2毒株进行改进,使之能够适应小鼠呼吸道。他们构建出的这种SARS-CoV-2突变株,称为MASCp6,它能够在年轻小鼠和老龄小鼠中复制,并且这两组小鼠在遭受鼻内MASCp6感染后均出现肺炎和炎症反应,这是在人类患者中观察到的临床特征。
这些研究人员说,与SARS-CoV-2相比,对MASCp6基因组的深度测序显示,这种病毒的刺突蛋白的受体结合结构域(RBD)发生突变可能是MASCp6能够进入小鼠ACE2阳性细胞的原因。(生物谷 Bioon.com)

SARS-CoV-2(之前称为2019-nCoV)的透射电镜图,图片来自NIAID RML。
2020年2月11日,世卫组织将这种疾病病重命名为2019年冠状病毒病(COVID-19)。同一天,负责分类和命名病毒的的国际病毒分类学委员会的冠状病毒研究小组在bioRxiv上发表了一篇文章,指出该研究小组已经决定,新型冠状病毒2019-nCoV是导致2002-2003年爆发严 重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)的变种。因此,将这种新病原体重新命名为严重急性呼吸综合征冠状病毒2号(severe acute respiratory syndrome coronavirus 2),或SARS-CoV-2。值得注意的一点是,尽管国际病毒分类委员会冠状病毒研究小组将 病毒命名为SARS-CoV-2,但该研究小组主席John Ziebuhr认为这个名字(SARS-CoV-2)和SARS(严重急性呼吸综合征,也称非典型肺炎)没有关联。不过,这种病毒的重新命名引起了不少争议。据《科学》网站报道,世界卫生组织不满意SARS-CoV-2这个名字,而且不打 算采用此名称。
冠状病毒可引起多种动物的多系统感染。在此之前已有6种冠状病毒可以感染人类,它们主要引起人类的呼吸道感染:两种高度致命性的冠状病毒,即严重急性呼吸道综合征(SARS)冠状病毒(SARS-CoV)和中东呼吸综合征(MERS)冠状病毒(MERS-CoV);4种可导致温 和的上呼吸道疾病的冠状病毒,即HCoV-OC43、HCoV-229E、HCoV-NL63和HCoV-HKU1。
1.Science:深入分析人体对新冠病毒的抗体反应,为开发新的更有效疫苗奠定基础
doi:10.1126/science.abd4250
一种旨在从一滴血中检测病毒感染史的工具在COVID-19时代得到了升级。VirScan是一种可以确定1000多种不同病毒中哪些病毒感染过人的技术,如今还可以检测出包括SARS-CoV-2在内的冠状病毒的感染证据。在一项新的研究中,来自美国布莱根妇女医院和哈佛医学院的研究人员提供了大量关于人类对SARS-CoV-2的抗体反应的细节,以及这种反应在感染了更严重的COVID-19的个体中可能有什么不同。相关研究结果于2020年9月29日在线发表在Science期刊上,论文标题为“Viral epitope profiling of COVID-19 patients reveals cross-reactivity and correlates of severity”。

VirScan检测COVID-19患者血清中对SARS-CoV-2的体液反应。图片来自Science, 2020, doi:10.1126/science.abd4250。
在分析中,Elledge及其同事们通过使用VirScan分析了232名COVID-19患者和190名对照者在COVID-19出现前的血液样本,深入研究了对SARS CoV-2的抗体反应。他们确定了免疫系统可以识别的800个称为表位(epitope)的病毒位点。并非所有的表位都是一样的,有些表位可能被中和抗体识别,从而引起消除感染的反应。然而,如果身体产生了针对其他表位的抗体,它可能会启动一个不太有效的反应,从而让这种病毒占据优势。在某些情况下,包括SARS-CoV病毒在内的病毒甚至能够从身体的抗体反应中获益,利用抗体进入细胞,这种现象被称为抗体依赖性增强作用(antibody-dependent enhancement)。
就SARS-CoV-2而言,Elledge团队检测到了一系列针对不同表位的抗体频率。许多表位是公共表位(public epitope)---被大量患者的免疫系统识别的区域。其中的一个公共表位被79%的COVID-19患者识别。其他的表位被认为是私有的,只被少数人甚至一个人的免疫系统识别。10个表位存在于这种病毒进入宿主细胞所必需的关键区域,可能被中和抗体识别。该团队利用最具鉴别力的表位开发了一种快速 诊断测试方法。
2.两篇Science揭示一些重症COVID-19病例与基因突变或攻击人体的自身抗体有关
doi:10.1126/science.abd4570; doi:10.1126/science.abd4585
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。被新型冠状病毒SARS-CoV-2感染的人可能会出现从轻度到致命的症状。如今,两项新的研究表明一些威胁生命的病例可以追溯到患者免疫系统的薄弱环节。
在患有重症COVID-19的患者中,至少有3.5%的人的抗病毒防御基因存在突变。至少有10%的重症患者会产生攻击免疫系统而不是与病毒抗争的“自身抗体”。这些发现确定了危及生命的COVID-19的某些根本原因。相关研究结果以两篇论文的形式于2020年9月24日在线发表在Science期刊上,论文标题分别为“Inborn errors of type I IFN immunity in patients with life-threatening COVID-19”和“Auto-antibodies against type I IFNs in patients with life-threatening COVID-19”。
这两篇论文的通讯作者、美国洛克菲勒大学研究员Jean-Laurent Casanova说,在这么多患者中(987名患者中的101人)观察到这些有害抗体是“令人吃惊的发现”。“这两篇论文首次解释了为何COVID-19在某些人中如此严重,而其他大多数被同一病毒感染的人则不会如此。”
3.Science:超强效抗体混合物阻断新冠病毒附着宿主细胞
doi:10.1126/science.abe3354
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。在一项新的研究中,来自美国、法国、比利时和意大利的研究人员发现来自康复的COVID-19患者的超强效抗体(ultrapotent antibody)混合物可识别和封锁这种大流行冠状病毒的感染复合体(infection machinery),并阻止它进入细胞。每种类型的超强效抗体发挥的作用存在重叠,但是也略有不同。低剂量的这些超强效抗体,不管是单独使用还是混合在一起使用,都可以阻止SARS-CoV-2在肺部中复制,因而保护仓鼠在暴露于这种病毒时免受感染。相关研究结果于2020年9月24日在线发表在Science期刊上,论文标题为“Ultrapotent human antibodies protect against SARS-CoV-2 challenge via multiple mechanisms”。
这种抗体混合物的一个优点是,它们也可能防止在这次大流行期间这种冠状病毒出现的自然突变体形式逃避治疗。由于在这次冠状病毒大流行期间已在它的感染复合体中发现了一些突变体,使用抗体混合物可以中和一系列这样的病毒突变体。
4.Science:发现新冠病毒S蛋白的一个亚油酸结合口袋,为开发阻止这种病毒感染的药物奠定基础
doi:10.1126/science.abd3255
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。在一项新的研究中,来自英国布里斯托大学等研究机构的研究人员发现SARS-CoV-2刺突蛋白(S蛋白)中的一个可用于阻止这种冠状病毒感染人体细胞的药物可靶向口袋(druggable pocket,即这个S蛋白中的口袋可通过药物进行靶向结合)。他们表示,这些发现可能有助于战胜当前的COVID-19流行病,而且靶向这个新发现的口袋的小分子抗病毒药物可能有助于消除这种疾病。相关研究结果于2020年9月21日在线发表在Science期刊上,论文标题为“Free fatty acid binding pocket in the locked structure of SARS-CoV-2 spike protein”。论文通讯作者为布里斯托大学的Christiane Schaffitzel教授和马克斯-普朗克布里斯托最小生物学中心的Imre Berger教授。

比较一下结合LA和未结合LA的S蛋白的结构,图片来自Science, 2020, doi:10.1126/science.abd3255。
在这项突破性的研究中,这些研究人员使用了一种强大的成像技术--电子低温显微镜(cryo-EM),以近原子分辨率分析了SARS-CoV-2 S蛋白。在甲骨文公司(Oracle)高性能云计算的支持下,他们生成了SARS-CoV-2 S蛋白的三维结构,这样他们能够深入到S蛋白的内部,从而识别它的分子组成。
出乎意料的是,这些研究人员的分析发现在S蛋白内的一个特制的口袋里,埋藏着一个小分子---亚油酸(LA)。LA是一种游离脂肪酸,是许多细胞功能不可或缺的物质。人体不能产生LA。相反,身体通过饮食吸收这种必需的分子。耐人寻味的是,LA在炎症和免疫调节中起着至关重要的作用,而这两者都是COVID-19疾病进展的关键因素。LA还能够维持肺部中的细胞膜,以便我们能够正常呼吸。
5.Science:长期感染新冠病毒对免疫系统的长期有效反应产生影响
doi:10.1126/science.abd7343
新研究表明,自然免疫和疫苗诱导的免疫力将成为影响全球冠状病毒大流行(COVID-19)未来发展轨迹的关键因素。普林斯顿大学研究人员做出的这项研究成果最近发表在《Science》杂志上。研究表明,开发一种能够引起强烈免疫反应的疫苗可以大大减少未来的感染负担。
文章共同第一作者Chadi Saad-Roy说:“到目前为止,与COVID-19的未来发展轨迹有关的讨论都正确地集中在季节性和非药物干预的影响上,例如,戴口罩和社交隔离。从短期来看,在大流行阶段,非传染性疾病是决定病例负担的关键因素。但是,随着我们对未来的展望,免疫的作用将变得越来越重要。”
6.Science:揭示SARS-CoV-2在欧洲和北美的传播
doi:10.1126/science.abc8169
在一项新的研究中,来自美国、英国、加拿大和比利时的研究人员将来自冠状病毒样本的进化基因组学数据与计算机模拟的流行病学数据和详细的旅行记录相结合,以前所未有的细节重建冠状病毒SARS-CoV-2在世界各地的传播。相关研究结果于2020年9月10日在线发表在Science期刊上,论文标题为“The emergence of SARS-CoV-2 in Europe and North America”。这些研究结果表明,在加强检测和接触者追踪可能阻止SARS-CoV-2在北美和欧洲建立的过程中,一个长时间的机会期错过了。
这篇论文还挑战了将今年1月份各大洲最早的已知COVID-19病例与数周后检测到的疫情爆发联系起来的建议,并提供了有价值的见解,可以为公共卫生响应提供信息,并有助于预测和预防未来COVID-19和其他人畜共患病的爆发。
论文共同通讯作者、亚利桑那大学研究员Michael Worobey说,“我们的愿望是开发和应用强大的新技术,在全球范围内对疫情如何在空间和时间上传播进行明确的分析。在此之前,科学、社交媒体和数量空前的等着同行评审的预印本文章的大杂烩中充斥着各种各样的可能性。”
7.Science:揭示新冠病毒在美国华盛顿州的隐性传播
doi:10.1126/science.abc0523
对SARS-CoV-2的基因组测序可以重建它的传播历史,不过这取决于采样情况。在一项新的研究中,来自美国多家研究机构的研究人员分析了2020年2月20日至3月15日期间从来自美国华盛顿州的感染患者体内收集的453个SARS-CoV-2基因组。他们发现,在此期间采样的大多数SARS-CoV-2感染源于2020年1月底或2月初的一次病毒输入,随后这种病毒在实施积极的社区监测之前在当地传播。相关研究结果近期发表在Science期刊上,论文标题为“Cryptic transmission of SARS-CoV-2 in Washington state”。

图片来自Science, 2020, doi:10.1126/science.abc0523。
这些结果突出表明,即使在当前疫情得到控制之后,仍有必要在美国和世界其他地区广泛监测SARS-CoV-2的社区传播。疾病严重程度的广泛性使得监测工作面临挑战。传统的公共卫生监测和基因组流行病学的结合可以提供可操作的新见解,就像这项研究中提及的那样:在2020年2月29日对最初的社区病例进行测序后,结果立即与美国国家、州和地方公共卫生部门分享,从而在西雅图市和华盛顿州掌握现有的COVID-19传播范围时迅速推出社会隔离政策。西雅图当地传播的确认促使检测标准发生变化,以着重关注没有旅行史的个人。从2月29日起,新的基因组数据立即发布到GISAID EpiCoV序列数据库,并通过Nextstrain在线平台与其他公开的SARS-CoV-2基因组一起进行分析,以提供即时和公众的形势意识。这些研究人员认为,社区监测、基因组分析和公众实时分享结果的结合,将增强传染病监测新系统的能力。
8.Science:计算机设计的小蛋白可高效抑制新冠病毒感染
doi:10.1126/science.abd9909
SARS-CoV-2是导致新冠肺炎(COVID-19)的冠状病毒。在一项新的研究中,来自美国华盛顿大学和乔治亚大学的研究人员发现计算机设计的小蛋白(miniprotein)可以保护实验室培养的人细胞免受SARS-CoV-2感染。相关研究结果于2020年9月9日在线发表在Science期刊上,论文标题为“De novo design of picomolar SARS-CoV-2 miniprotein inhibitors”。
在实验中,一种被命名为LCB1的主要抗病毒候选药物在保护作用上可与最著名的SARS-CoV-2中和抗体相媲美。LCB1目前正在啮齿动物中进行评估。
9.Science:揭示基因CIITA诱导人细胞抵抗埃博拉病毒和SARS样冠状病毒感染机制
doi:10.1126/science.abb3753
在一项新的研究中,来自美国弗吉尼亚梅森大学贝纳罗亚研究所、凯斯西储大学、波士顿大学医学院和MRIGlobal公司的研究人员发现了一种新的细胞保护途径,该途径靶向几种不同大流行病毒中的共同弱点。他们发现这种途径可以保护细胞免受埃博拉病毒和诸如SARS-CoV-2之类的冠状病毒感染。这些新发现使得人们更好地理解参与抵抗病毒感染的细胞机制,从而为治疗未来病毒性传染病提供参考。相关研究结果于2020年8月27日在线发表在Science期刊上,论文标题为“MHC class II transactivator CIITA induces cell resistance to Ebola virus and SARS-like coronaviruses”。
这项研究阐明了所发现的两个基因的全新作用,以及抑制病毒融合和进入人体细胞的独特方法,这使得我们离下一代抗病毒疗法更近了一步。这些研究人员利用转座子介导的基因激活筛选方法,寻找可以阻止埃博拉病毒感染的新基因。
这种新的筛选策略可作为发现针对其他危险病原体的抵抗机制的蓝本。利用这种策略,这些研究人员发现了基因CIITA(MHC class II transactivator,MHCII类反式激活蛋白)通过激活第二个基因CD74的表达,诱导人细胞系产生抵抗力。作为CD74的一种形式,p41破坏了称为组织蛋白酶(Cathepsin)的细胞蛋白酶对埃博拉病毒蛋白外壳上的蛋白的加工。这可以阻止这种病毒进入细胞和感染。p41还会阻断包括SARS-CoV-2在内的冠状病毒的组织蛋白酶依赖性进入途径。
10.Science:针对刺突蛋白的新发现揭示了新冠病毒感染人细胞的能力
doi:10.1126/science.abd5223
在SARS-CoV-2感染初期,这种病毒利用它的表面上的刺突蛋白(S蛋白)附着到人体细胞上。S蛋白是疫苗研发的核心,这是因为它能触发人体免疫反应。在一项新的研究中,来自德国马克斯-普朗克生物物理学研究所(MPI)、欧洲分子生物学实验室(EMBL)、保罗-埃里希研究院(Paul-Ehrlich-Institut,PEI)和法兰克福歌德大学等研究机构的研究人员着重关注这种病毒的表面结构,以获得可用于开发疫苗和治疗感染患者的有效疗法的新见解。相关研究结果于2020年8月18日在线发表在Science期刊上,论文标题为“In situ structural analysis of SARS-CoV-2 spike reveals flexibility mediated by three hinges”。

图片来自Science, 2020, doi:10.1126/science.abd5223。
这些作者结合低温电子断层扫描(cryo-electron tomography, cryo-ET)、子断层扫描图平均化(subtomogram averaging)和分子动力学模拟,在近原子分辨率下分析了S蛋白在它的自然环境中、完整病毒颗粒上的分子结构。利用EMBL最先进的低温电镜成像设备,他们生成了大约1000个SARS-CoV-2病毒的266幅低温电子断层扫描图,每个病毒表面平均携带40个S蛋白刺突。子断层扫描图平均化和图像处理,再结合分子动力学模拟,最终提供了关于这些S蛋白刺突的重要和新的结构信息。
这些结果令人吃惊:他们的数据显示,S蛋白的球状部分,包含受体结合区域和与靶细胞融合所需的区域,而且这个球状部分连接到一个柔性的茎区域。论文共同通讯作者、EMBL小组负责人、MPI主任Martin Beck解释道,“S蛋白刺突的上部球状部分具有用于疫苗开发的重组蛋白很好重现的结构。然而,我们关于茎区域将S蛋白的球状部分固定在病毒表面上的发现是新的。”
11.Science:揭示重症COVID-19患者出现免疫系统瘫痪
doi:10.1126/science.abc6261
在一项新的研究中,来自美国斯坦福大学、埃默里大学和中国香港大学、香港医院管理局的研究人员发现在病情严重的COVID-19患者中,应当对体内病毒或细菌的迹象立即做出反应的“第一反应者” 免疫细胞反应迟钝。相关研究结果于2020年8月11日在线发表在Science期刊上,论文标题为“Systems biological assessment of immunity to mild versus severe COVID-19 infection in humans”。
有些人因COVID-19而真正生病,而有些人却没有。没有人知道为什么。如今,在这项研究中,这些作者发现了 免疫学上的偏差和失误似乎可以区分重度和轻度的COVID-19病例之间的差异。
这种差异可能源于我们进化上古老的先天免疫系统如何应对SARS-CoV-2,即导致COVID-19的冠状病毒。从果蝇到人类的所有生物中都有先天免疫系统,它能迅速感知病毒和其他病原体。一旦它感知到,它就会立即对它们发起一种不加区分的攻击,并调动更精确靶向的但行动缓慢的“神枪手”细胞,它们属于人体病原体防御力量的另一个分支---适应性免疫系统。
论文通讯作者、斯坦福大学医学院病理学教授、微生物学与免疫学教授Bali Pulendran博士说,“这些发现揭示了免疫系统如何在冠状病毒感染期间出错而导致严重的疾病,并指出了潜在的治疗靶标。”论文第一作者为斯坦福大学博士后学者Prabhu Arnunachalam博士、Florian Wimmers博士以及香港大学公共卫生实验室科学助理教授Chris Ka Pun Mok博士和Mahen Perera博士。
12.Science:重磅!鉴定出横跨冠状病毒双膜囊泡的分子孔
doi:10.1126/science.abd3629; doi:10.1126/science.abe0322
在一项新的研究中,来自荷兰莱顿大学医疗中心、德国莱布尼茨实验病毒学研究所、汉堡大学和美国加州大学旧金山分校的研究人员通过可视化观察冠状病毒在受感染的宿主细胞中的复制,可能解答了一个长期存在的问题,即新合成的冠状病毒组分如何能够被整合到具有完全传染性的病毒中。相关研究结果于2020年8月6日在线发表在Science期刊上,论文标题为“A molecular pore spans the double membrane of the coronavirus replication organelle”。论文通讯作者为莱顿大学医疗中心的Montserrat Bárcena。论文第一作者为莱顿大学医疗中心的Georg Wolff。
冠状病毒在宿主细胞的细胞质中复制它们的庞大基因组。它们通过将宿主细胞膜转化为奇特的双膜囊泡(double-membrane vesicle, DMV)来实现这一点。新制造的病毒RNA需要从这些DMV输出到细胞质中,才能被包装成完整的、具有传染性的冠状病毒。然而,到目前为止,在DMV复制区室中还没有检测到通往细胞质的开口。
在这项新的研究中,为了寻求了解病毒RNA如何从封闭的DMA中运输出去,这些研究人员利用电子断层成像技术可视化观察小鼠肝炎冠状病毒(mouse hepatitis coronavirus)感染宿主细胞的中间阶段,由于原位低温电镜研究的生物安全限制,他们使用小鼠肝炎冠状病毒来代替SARS-CoV-2。
他们鉴定出一种冠状病毒特异性的冠状结构--跨越DMV两层膜的分子孔,它可能在RNA从DMV复制区室中释放出来的过程中发挥作用。在使用SARS-CoV-2感染细胞的预固定样本的进一步研究工作中,他们发现这种结构也存在于SARS-CoV-2诱导的DMV中。
13.Science:利用经过基因改造的人ACE受体作为诱饵引诱新冠病毒,阻断感染
doi:10.1126/science.abc0870; doi:10.1126/science.abe0010
在一项新的研究中,来自美国伊利诺伊大学香槟分校等研究机构的研究人员指出利用诱饵受体(decoy receptor)---一种经过改造的自由漂浮的受体蛋白---引诱SARS-CoV-2,这样这种诱饵受体就可结合这种病毒并阻止感染。相关研究结果于2020年8月4日在线发表在Science期刊上,论文标题为“Engineering human ACE2 to optimize binding to the spike protein of SARS coronavirus 2”。论文通讯作者为伊利诺伊大学香槟分校的的生物化学教授Erik Procko博士。
要感染人类细胞,病毒必须首先与细胞表面的受体蛋白结合。SARS-CoV-2是导致COVID-19的冠状病毒,它与一种名为ACE2的受体结合。ACE2在调节血压、血容量和炎症方面发挥着多种作用。它存在于全身组织中,特别是在肺部、心脏、动脉、肾脏和肠道中。科学家们推测,与COVID-19相关的一系列症状可能源于这种冠状病毒与ACE2结合并使得后者无法执行它的正常功能。
Procko说,“给予基于ACE2的诱饵受体可能不仅可以中和感染,而且还可能具有拯救失去的ACE2活性和直接治疗COVID-19方面的额外好处。”
14.Science:震惊!暴露于普通感冒冠状病毒可以教会人体免疫系统识别SARS-CoV-2
doi:10.1126/science.abd3871
新型冠状病毒SARS-CoV-2导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。在一项新的研究中,来自美国拉霍亚 免疫学研究所、北卡罗莱纳大学医学院、加州大学圣地亚哥分校和澳大利亚莫道克大学的研究人员发现识别普通感冒冠状病毒的记忆辅助性T细胞也能识别SARS-CoV-2上的匹配位点。相关研究结果于2020年8月4日在线发表在Science期刊上,论文标题为“Selective and cross-reactive SARS-CoV-2 T cell epitopes in unexposed humans”。

图片来自Science, 2020, doi:10.1126/science.abd3871。
论文共同通讯作者、拉霍亚免疫学研究所研究助理教授Daniela Weiskopf博士,“我们如今证明,在一些人中,预先存在的针对普通感冒冠状病毒的T细胞记忆可以交叉识别SARS-CoV-2,甚至可以精确到分子结构上。这可能有助于解释为什么有些人表现出较轻的疾病症状,而另一些人则会严重生病。”
15.Science:详解我国科学家开发出适应小鼠的SARS-CoV-2毒株,可用于测试疫苗疗效
doi:10.1126/science.abc4730
在一项新的研究中,中国军事医学科学院微生物流行病研究所的孙世惠(Shihui Sun)、秦成峰(Cheng-Feng Qin)和周育森(Yusen Zhou, 已故)以及复旦大学病原微生物研究所的姜世勃(Shibo Jiang)等人开发出一种适应小鼠的SARS-CoV-2毒株,它能够在呼吸道中高效复制,并且在有免疫活性的野生型小鼠中引起间质性肺炎。此外,他们还在用这种SARS-CoV-2毒株进行挑战的小鼠模型中测试了一种新开发的重组亚单位候选疫苗的保护效果。相关研究结果于2020年7月30日在线发表在Science期刊上,论文标题为“Adaptation of SARS-CoV-2 in BALB/c mice for testing vaccine efficacy”。
在这项新的研究中,这些研究人员并不采取对小鼠进行基因改造使之表达人ACE2的方法,相反,他们采取了一种新的策略:他们对在临床上观察到的一种SARS-CoV-2毒株进行改进,使之能够适应小鼠呼吸道。他们构建出的这种SARS-CoV-2突变株,称为MASCp6,它能够在年轻小鼠和老龄小鼠中复制,并且这两组小鼠在遭受鼻内MASCp6感染后均出现肺炎和炎症反应,这是在人类患者中观察到的临床特征。
这些研究人员说,与SARS-CoV-2相比,对MASCp6基因组的深度测序显示,这种病毒的刺突蛋白的受体结合结构域(RBD)发生突变可能是MASCp6能够进入小鼠ACE2阳性细胞的原因。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


