神奇!同一天内Nature发表3篇关于cGAS的论文,Science发表2篇cGAS论文,从不同角度揭示核小体结合抑制cGAS从而阻止自身免疫反应机制
来源:本站原创 2020-09-23 06:51
2020年9月23日讯/生物谷BIOON/---高等生物细胞中的大部分DNA被限制在细胞核中,而所有其他细胞器DNA都被限制在细胞质中确定的细胞区室内。因此,DNA出现在细胞质的可溶性相(soluble phase)被先天免疫系统解释为细胞内病原体---通常是细菌或病毒---存在的信号,尽管肿瘤细胞和衰老细胞也可以将细胞核DNA或线粒体DNA释放到细胞质中。
2020年9月23日讯/生物谷BIOON/---高等生物细胞中的大部分DNA被限制在细胞核中,而所有其他细胞器DNA都被限制在细胞质中确定的细胞区室内。因此,DNA出现在细胞质的可溶性相(soluble phase)被先天免疫系统解释为细胞内病原体---通常是细菌或病毒---存在的信号,尽管肿瘤细胞和衰老细胞也可以将细胞核DNA或线粒体DNA释放到细胞质中。错位的DNA---无论是来自细胞核、线粒体还是细胞外的DNA---都会引起强烈的免疫反应,这种反应是由cGAS酶启动的。长期以来,科学家们一直认为cGAS本身只定位在细胞质中。
然而,近期的研究已表明,这种蛋白实际上优先存在于细胞核中。这一发现自然而然地提出了一个问题:是什么阻止了cGAS与细胞核DNA结合并引发自身免疫反应。
在所有哺乳动物中,环状GMP-AMP合酶(cGAS)感知病原DNA的入侵,并刺激炎症信号转导、自噬和凋亡。cGAS都是通过检测处于错误位置的DNA来发挥作用的。在正常条件下,DNA被紧密地包装在细胞核中并受到保护。DNA没有理由会在细胞周围自由移动。当DNA片段确实最终逃离细胞核并进入细胞质中时,这通常表明存在着一些不祥之兆,比如来自细胞内的损伤或来自侵入细胞内的病毒或细菌的外来DNA。
cGAS蛋白通过识别这种处于错误位置的DNA而发挥作用。在正常情形下,它在细胞中处于休眠状态。但是一旦cGAS检测到DNA存在于细胞核外面,它就突然起作用。它产生另一种化学物质---一种被称作2'3'环状GMP-AMP(cGAMP)的第二种信使,从而引发一种分子链反应,结果就是提醒细胞中的DNA异常存在。在这种信号级联反应结束时,细胞要么得到修复,要么因损坏到无法修复的地步,它就会自我破坏。
但是细胞的健康和完整性取决于cGAS能够将无害的DNA和外来DNA或在细胞遭受损伤和应激期间释放出的自身DNA区分开来。
由此可见,cGAS在包括人类在内的哺乳动物起着非常重要的作用。2020年9月10日,Nature期刊和Science期刊各不相让,分别发表了3篇和2篇关于cGAS的论文,而且都涉及cGAS的结构。接下来,让我们一探究竟吧。
1.Nature:揭示核小体结合导致cGAS失活的分子基础
doi:10.1038/s41586-020-2749-z
病原体来源的核酸能诱导强有力的先天免疫反应。环状GMP-AMP合酶(cGAS)是一种双链DNA(dsDNA)传感蛋白,可催化合成环状二核苷酸cGAMP,所产生的cGAMP通过STING-TBK1-IRF3信号轴介导I型干扰素的诱导。cGAS存在于细胞质中,它对自身DNA不具有反应性已被广泛接受。然而,近期的研究已表明,cGAS主要存在于细胞核中,紧密的核小体束缚让cGAS保持在非活性状态。
在一项新的研究中,来自美国德州农工大学的研究人员发现cGAS以纳米摩尔亲和力结合核小体,而且核小体结合强有力地抑制cGAS的催化活性。为了阐明核小体结合导致cGAS失活的分子基础,他们确定了小鼠cGAS与人核小体结合在一起时的低温电镜(cryo-EM)结构。相关研究结果于2020年9月10日在线发表在Nature期刊上,论文标题为“The Molecular Basis of Tight Nuclear Tethering and Inactivation of cGAS”。
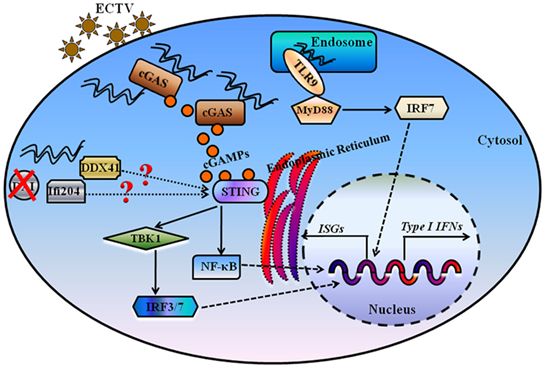
这种结构表明cGAS通过它的第二DNA结合位点与组蛋白H2A和H2B形成的带负电的酸性口袋(acidic patch)结合。高亲和力的核小体结合阻止dsDNA结合,并使cGAS处于非活性构象。破坏核小体结合的cGAS突变极大地影响细胞中cGAS介导的信号转导。
2.Nature:揭示核小体抑制cGAS的结构机制
doi:10.1038/s41586-020-2750-6
在一项新的研究中,来自瑞士洛桑联邦理工学院和巴塞尔大学的研究人员确定了人cGAS与核小体结合在一起时的分辨率为3.1埃的低温电镜(cryo-EM)结构。相关研究结果于2020年9月10日在线发表在Nature期刊上,论文标题为“Structural mechanism of cGAS inhibition by the nucleosome”。
cGAS与组蛋白H2A-H2B异源二聚体的酸性口袋(acidic patch)和核小体DNA广泛接触。结构和互补生化分析还发现cGAS与第二个核小体反式结合。从机制上看,核小体结合将cGAS锁定在单体状态,在这种状态下,空间位阻抑制了基因组DNA对cGAS的错误激活。
这些研究人员发现,cGAS-酸性口袋界面上发生的突变足以在体外消除核小体对cGAS的抑制作用以及在活细胞中触发cGAS在基因组DNA上的酶活性。
这项研究揭示了cGAS与染色质相互作用的结构基础,并确定了一个令人信服的机制,从而允许cGAS对基因组DNA进行自我-非自我识别。
3.Science:揭示核小体抑制cGAS激活的结构基础
doi:10.1126/science.abd0237
有人提出宿主DNA组装成核小体可限制cGAS的自动激活,但是它的基本机制尚不清楚。在一项新的研究中,来自日本东京大学、早稻田大学和美国洛克菲勒大学的研究人员报告了这种抑制的结构基础。相关研究结果于2020年9月10日在线发表在Science期刊上,论文标题为“Structural basis for the inhibition of cGAS by nucleosomes”。
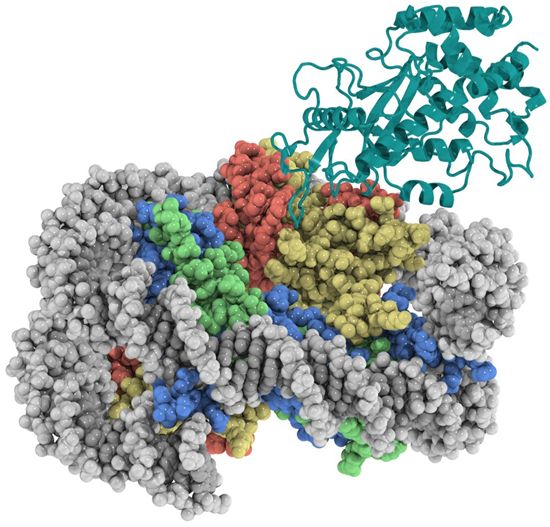
这些研究人员解析出人cGAS-核小体核心颗粒(cGAS-NCP)复合物的低温电镜(cryo-EM)结构。在这种结构中,两个cGAS单体通过结合H2A-H2B的酸性口袋(acidic patch)和核小体DNA来桥接两个核小体核心颗粒(NCP)。
在这种构型下,cGAS激活所需要的所有三个已知的cGAS DNA结合位点都被重新利用或无法进入,而且作为cGAS激活的另一个先决条件,cGAS二聚作用被抑制。让将cGAS和H2A-H2B的酸性口袋连接在一起的关键氨基酸残基发生突变可减轻核小体对cGAS激活的抑制。
总之,这项新的研究建立了一个结构框架,解释了为何cGAS在染色质的自我DNA上受到抑制。
4.Science:从结构上揭示核小体依赖性的cGAS抑制机制
doi:10.1126/science.abd0609
在一项新的研究中,来自美国北卡罗来纳大学教堂山分校的研究人员首次确定了先天免疫系统中一种名为cGAS的关键DNA感应蛋白与核小体结合在一起时的高分辨率结构,其中核小体是细胞核内最重要的DNA包装单位。相关研究结果于2020年9月10日在线发表在Science期刊上,论文标题为“Structural basis of nucleosome-dependent cGAS inhibition”。
这项研究详细揭示了我们细胞内的核小体如何阻止cGAS无意中触发人体对自身DNA的先天免疫反应。论文通讯作者为北卡罗来纳大学教堂山分校医学院生物化学与生物物理学副教授Qi Zhang博士和北卡罗来纳大学教堂山分校艾谢尔曼药学院化学生物学与药物化学助理教授Robert McGinty博士。
利用2019年成立的北卡罗来纳大学教堂山分校医学院最先进的冷冻电镜核心设施,Zhang和McGinty实验室确定了cGAS与核小体结合在一起时的3.3埃分辨率的冷冻电镜结构。这种结构显示cGAS利用两个保守的氨基酸锚定在核小体表面的负电荷的酸性口袋(acidic patch)上。这些蛋白-蛋白之间的相互作用使得核小体占据了cGAS上的一个关键的DNA传感表面,并阻止cGAS进入它的功能活跃的DNA结合状态。结合诱变和功能测定,这项研究为cGAS如何在细胞核中维持静止、抑制状态在近原子分辨率下进行了描述。
5.Nature:重大进展!揭示染色质抑制cGAS从而阻止自身免疫反应机制
doi:10.1038/s41586-020-2748-0
在高等生物中,检测到细胞质中的DNA会引发免疫反应。感知“错位”DNA的酶也存在于细胞核中,但细胞核DNA没有这样的效果。如今,在一项新的研究中,来自德国慕尼黑大学的研究人员报告了为何会这样。相关研究结果于2020年9月10日在线发表在Nature期刊上,论文标题为“Structural basis for sequestration and autoinhibition of cGAS by chromatin”。
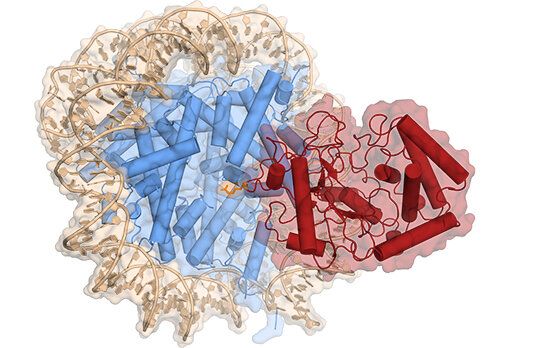
在这项新的研究中,由Karl-Peter Hopfner教授领导的慕尼黑大学基因中心的一个科学家团队与Veit Hornung教授及其同事们合作,揭示了cGAS与细胞核中染色体DNA相互作用的性质,并解释了为什么这种相互作用不能激活先天免疫系统。
cGAS与细胞核DNA结合后,会合成一种触发细胞内信号级联反应的信使分子,从而导致介导炎症反应的蛋白产生。这个过程对于消除感染性病原体是必不可少的。然而,它也与自身免疫疾病的产生有关,其中的一些疾病实际上涉及针对细胞自身DNA的抗体的产生。因此,cGAS存在于细胞核中的事实似乎与先天免疫系统的保护功能不一致,这是因为细胞核中的这种酶本身的激活会导致针对细胞核DNA的自身免疫反应。Hopfner说,“奇怪的是,最近的数据实际上表明,cGAS与在细胞核中发现的DNA-蛋白复合物---即所谓的染色质---的紧密结合对于预防基于DNA的自身免疫至关重要。”
在染色质复合物中,DNA被包裹在由称为核心组蛋白(core histone)的蛋白组成的盘状颗粒上。由此产生的“核小体”由与核心组蛋白没有直接关联的“接头DNA(linker DNA)”连接在一起。通过低温电镜,Hopfner及其同事们能够证实cGAS仅与染色质的蛋白成分结合,而不与DNA本身相互作用。论文共同第一作者、慕尼黑大学的Carina de Oliveira Mann说,“这是一个很大的惊喜。此外,它的结合模式确保了cGAS的DNA识别位点被阻断。因此,即使在基因激活过程中,它附近的DNA可以接近其他蛋白,这种酶也会在细胞核中失去活性。矛盾的是,这提示着,通过将这种酶困于非活性状态,染色质实际上是cGAS的储存库。”
事实上,cGAS在染色质中包裹不那么紧密的区域内被最有效地抑制,大多数基因都位于这些区域。Hopfner说,“这可能解释为什么cGAS在细胞质中被称为微核(micronuclei)的东西激活,在那里染色质被认为是紧密包裹的。”微核由受到核膜包围的染色体片段组成。它们是快速生长的肿瘤细胞中染色体分离错误或电离辐射造成的DNA损伤的产物。(生物谷 Bioon.com)
然而,近期的研究已表明,这种蛋白实际上优先存在于细胞核中。这一发现自然而然地提出了一个问题:是什么阻止了cGAS与细胞核DNA结合并引发自身免疫反应。
在所有哺乳动物中,环状GMP-AMP合酶(cGAS)感知病原DNA的入侵,并刺激炎症信号转导、自噬和凋亡。cGAS都是通过检测处于错误位置的DNA来发挥作用的。在正常条件下,DNA被紧密地包装在细胞核中并受到保护。DNA没有理由会在细胞周围自由移动。当DNA片段确实最终逃离细胞核并进入细胞质中时,这通常表明存在着一些不祥之兆,比如来自细胞内的损伤或来自侵入细胞内的病毒或细菌的外来DNA。
cGAS蛋白通过识别这种处于错误位置的DNA而发挥作用。在正常情形下,它在细胞中处于休眠状态。但是一旦cGAS检测到DNA存在于细胞核外面,它就突然起作用。它产生另一种化学物质---一种被称作2'3'环状GMP-AMP(cGAMP)的第二种信使,从而引发一种分子链反应,结果就是提醒细胞中的DNA异常存在。在这种信号级联反应结束时,细胞要么得到修复,要么因损坏到无法修复的地步,它就会自我破坏。
但是细胞的健康和完整性取决于cGAS能够将无害的DNA和外来DNA或在细胞遭受损伤和应激期间释放出的自身DNA区分开来。
由此可见,cGAS在包括人类在内的哺乳动物起着非常重要的作用。2020年9月10日,Nature期刊和Science期刊各不相让,分别发表了3篇和2篇关于cGAS的论文,而且都涉及cGAS的结构。接下来,让我们一探究竟吧。
1.Nature:揭示核小体结合导致cGAS失活的分子基础
doi:10.1038/s41586-020-2749-z
病原体来源的核酸能诱导强有力的先天免疫反应。环状GMP-AMP合酶(cGAS)是一种双链DNA(dsDNA)传感蛋白,可催化合成环状二核苷酸cGAMP,所产生的cGAMP通过STING-TBK1-IRF3信号轴介导I型干扰素的诱导。cGAS存在于细胞质中,它对自身DNA不具有反应性已被广泛接受。然而,近期的研究已表明,cGAS主要存在于细胞核中,紧密的核小体束缚让cGAS保持在非活性状态。
在一项新的研究中,来自美国德州农工大学的研究人员发现cGAS以纳米摩尔亲和力结合核小体,而且核小体结合强有力地抑制cGAS的催化活性。为了阐明核小体结合导致cGAS失活的分子基础,他们确定了小鼠cGAS与人核小体结合在一起时的低温电镜(cryo-EM)结构。相关研究结果于2020年9月10日在线发表在Nature期刊上,论文标题为“The Molecular Basis of Tight Nuclear Tethering and Inactivation of cGAS”。

图片来自Frontiers in Immunology, 2018, doi:10.3389/fimmu.2018.01297。
这种结构表明cGAS通过它的第二DNA结合位点与组蛋白H2A和H2B形成的带负电的酸性口袋(acidic patch)结合。高亲和力的核小体结合阻止dsDNA结合,并使cGAS处于非活性构象。破坏核小体结合的cGAS突变极大地影响细胞中cGAS介导的信号转导。
2.Nature:揭示核小体抑制cGAS的结构机制
doi:10.1038/s41586-020-2750-6
在一项新的研究中,来自瑞士洛桑联邦理工学院和巴塞尔大学的研究人员确定了人cGAS与核小体结合在一起时的分辨率为3.1埃的低温电镜(cryo-EM)结构。相关研究结果于2020年9月10日在线发表在Nature期刊上,论文标题为“Structural mechanism of cGAS inhibition by the nucleosome”。
cGAS与组蛋白H2A-H2B异源二聚体的酸性口袋(acidic patch)和核小体DNA广泛接触。结构和互补生化分析还发现cGAS与第二个核小体反式结合。从机制上看,核小体结合将cGAS锁定在单体状态,在这种状态下,空间位阻抑制了基因组DNA对cGAS的错误激活。
这些研究人员发现,cGAS-酸性口袋界面上发生的突变足以在体外消除核小体对cGAS的抑制作用以及在活细胞中触发cGAS在基因组DNA上的酶活性。
这项研究揭示了cGAS与染色质相互作用的结构基础,并确定了一个令人信服的机制,从而允许cGAS对基因组DNA进行自我-非自我识别。
3.Science:揭示核小体抑制cGAS激活的结构基础
doi:10.1126/science.abd0237
有人提出宿主DNA组装成核小体可限制cGAS的自动激活,但是它的基本机制尚不清楚。在一项新的研究中,来自日本东京大学、早稻田大学和美国洛克菲勒大学的研究人员报告了这种抑制的结构基础。相关研究结果于2020年9月10日在线发表在Science期刊上,论文标题为“Structural basis for the inhibition of cGAS by nucleosomes”。

蛋白cGAS(蓝绿色,顶部)与核小体结合在一起时的首个高分辨率结构,图片来自UNC-Chapel Hill。
这些研究人员解析出人cGAS-核小体核心颗粒(cGAS-NCP)复合物的低温电镜(cryo-EM)结构。在这种结构中,两个cGAS单体通过结合H2A-H2B的酸性口袋(acidic patch)和核小体DNA来桥接两个核小体核心颗粒(NCP)。
在这种构型下,cGAS激活所需要的所有三个已知的cGAS DNA结合位点都被重新利用或无法进入,而且作为cGAS激活的另一个先决条件,cGAS二聚作用被抑制。让将cGAS和H2A-H2B的酸性口袋连接在一起的关键氨基酸残基发生突变可减轻核小体对cGAS激活的抑制。
总之,这项新的研究建立了一个结构框架,解释了为何cGAS在染色质的自我DNA上受到抑制。
4.Science:从结构上揭示核小体依赖性的cGAS抑制机制
doi:10.1126/science.abd0609
在一项新的研究中,来自美国北卡罗来纳大学教堂山分校的研究人员首次确定了先天免疫系统中一种名为cGAS的关键DNA感应蛋白与核小体结合在一起时的高分辨率结构,其中核小体是细胞核内最重要的DNA包装单位。相关研究结果于2020年9月10日在线发表在Science期刊上,论文标题为“Structural basis of nucleosome-dependent cGAS inhibition”。
这项研究详细揭示了我们细胞内的核小体如何阻止cGAS无意中触发人体对自身DNA的先天免疫反应。论文通讯作者为北卡罗来纳大学教堂山分校医学院生物化学与生物物理学副教授Qi Zhang博士和北卡罗来纳大学教堂山分校艾谢尔曼药学院化学生物学与药物化学助理教授Robert McGinty博士。
利用2019年成立的北卡罗来纳大学教堂山分校医学院最先进的冷冻电镜核心设施,Zhang和McGinty实验室确定了cGAS与核小体结合在一起时的3.3埃分辨率的冷冻电镜结构。这种结构显示cGAS利用两个保守的氨基酸锚定在核小体表面的负电荷的酸性口袋(acidic patch)上。这些蛋白-蛋白之间的相互作用使得核小体占据了cGAS上的一个关键的DNA传感表面,并阻止cGAS进入它的功能活跃的DNA结合状态。结合诱变和功能测定,这项研究为cGAS如何在细胞核中维持静止、抑制状态在近原子分辨率下进行了描述。
5.Nature:重大进展!揭示染色质抑制cGAS从而阻止自身免疫反应机制
doi:10.1038/s41586-020-2748-0
在高等生物中,检测到细胞质中的DNA会引发免疫反应。感知“错位”DNA的酶也存在于细胞核中,但细胞核DNA没有这样的效果。如今,在一项新的研究中,来自德国慕尼黑大学的研究人员报告了为何会这样。相关研究结果于2020年9月10日在线发表在Nature期刊上,论文标题为“Structural basis for sequestration and autoinhibition of cGAS by chromatin”。

cGAS(红色)与核小体组蛋白(蓝色)结合在一起时的低温电镜结构,图片来自Karl-Peter Hopfner。
在这项新的研究中,由Karl-Peter Hopfner教授领导的慕尼黑大学基因中心的一个科学家团队与Veit Hornung教授及其同事们合作,揭示了cGAS与细胞核中染色体DNA相互作用的性质,并解释了为什么这种相互作用不能激活先天免疫系统。
cGAS与细胞核DNA结合后,会合成一种触发细胞内信号级联反应的信使分子,从而导致介导炎症反应的蛋白产生。这个过程对于消除感染性病原体是必不可少的。然而,它也与自身免疫疾病的产生有关,其中的一些疾病实际上涉及针对细胞自身DNA的抗体的产生。因此,cGAS存在于细胞核中的事实似乎与先天免疫系统的保护功能不一致,这是因为细胞核中的这种酶本身的激活会导致针对细胞核DNA的自身免疫反应。Hopfner说,“奇怪的是,最近的数据实际上表明,cGAS与在细胞核中发现的DNA-蛋白复合物---即所谓的染色质---的紧密结合对于预防基于DNA的自身免疫至关重要。”
在染色质复合物中,DNA被包裹在由称为核心组蛋白(core histone)的蛋白组成的盘状颗粒上。由此产生的“核小体”由与核心组蛋白没有直接关联的“接头DNA(linker DNA)”连接在一起。通过低温电镜,Hopfner及其同事们能够证实cGAS仅与染色质的蛋白成分结合,而不与DNA本身相互作用。论文共同第一作者、慕尼黑大学的Carina de Oliveira Mann说,“这是一个很大的惊喜。此外,它的结合模式确保了cGAS的DNA识别位点被阻断。因此,即使在基因激活过程中,它附近的DNA可以接近其他蛋白,这种酶也会在细胞核中失去活性。矛盾的是,这提示着,通过将这种酶困于非活性状态,染色质实际上是cGAS的储存库。”
事实上,cGAS在染色质中包裹不那么紧密的区域内被最有效地抑制,大多数基因都位于这些区域。Hopfner说,“这可能解释为什么cGAS在细胞质中被称为微核(micronuclei)的东西激活,在那里染色质被认为是紧密包裹的。”微核由受到核膜包围的染色体片段组成。它们是快速生长的肿瘤细胞中染色体分离错误或电离辐射造成的DNA损伤的产物。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


