多发性硬化症口服新药!下一代免疫调节剂IMU-838:快速抑制MRI病灶,疗效显著、安全性高!
来源:本站原创 2020-09-13 15:34
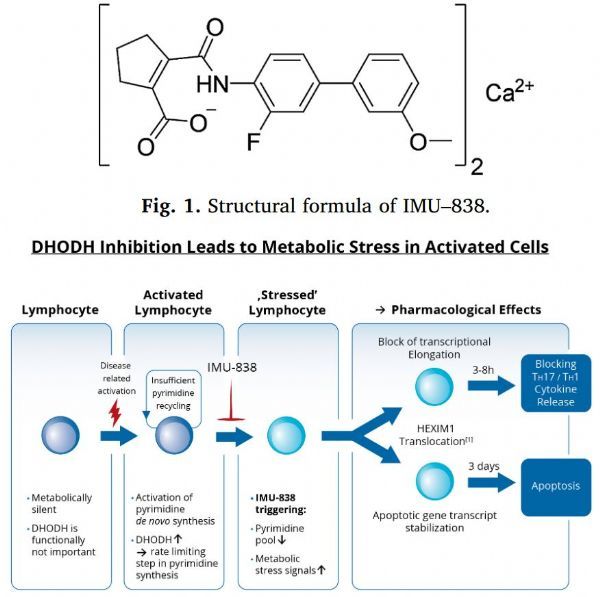
IMU-838通过阻断二氢乳清酸脱氢酶(DHODH)抑制活化的免疫细胞的细胞内代谢。

2020年09月13日讯 /生物谷BIOON/ --Immunic Therapeutics是一家临床阶段的生物制药公司,专注于开发治疗慢性炎症和自身免疫性疾病的同类最佳口服疗法。近日,该公司在第八届ACTRIMS-ECTRIMS联合会议MSVirtual2020上公布了其先导资产IMU-838治疗治疗复发-缓解型多发性硬化症(RRMS)II期EMPhASIS试验的完整非盲临床数据集。
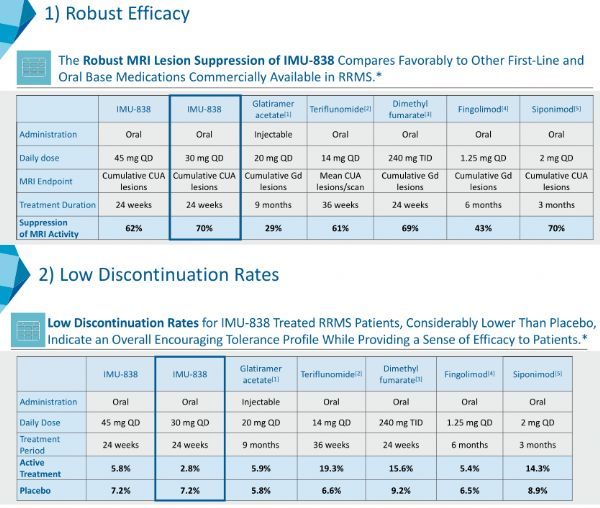
今年8月公布的阳性顶线结果显示,研究达到全部主要和关键次要终点,证实IMU-838治疗RRMS具有显著疗效,并且具有良好的安全性和耐受性。此次会上公布的数据,扩大并进一步证实了先前公布的阳性顶线结果。非盲亚组分析显示不同人群的MRI病灶抑制效果一致;MRI病灶抑制的时间进程显示,在第6周进行的基线后第一次扫描中已经出现病灶的减少,这验证了IMU-838能够快速达到稳定的治疗药物水平。此外,在IMU-838的2个治疗组中观察到血清神经丝轻链(sNfL,轴突损伤的生物标志物)水平显著降低,但安慰剂组没有观察到。这些结果支持了IMU-838有潜力为RRMS患者提供一种新的、方便的、每一次的、口服一线治疗方案。
研究结果的报告者、克利夫兰诊所神经研究所研究副主席、梅伦多发性硬化症中心神经科医师Robert J. Fox博士表示:“在RRMS患者中对IMU-838进行的II期研究的结果令人鼓舞,因为数据显示试验已经达到了主要和关键的次要终点,具有很高的统计意义。重要的是,IMU-838似乎安全且耐受性良好、具有强大的抑制活动MRI病灶的能力,这与RRMS领域的其他一线和口服药物相比更为有利。”
IMU-838是一款口服的下一代选择性免疫调节剂,通过阻断二氢乳清酸脱氢酶(DHODH)来抑制活化的免疫细胞的细胞内代谢。IMU-838作用于活化的T细胞和B细胞,同时使其他免疫细胞基本不受影响,并使免疫系统保持功能,例如抵抗感染。在先前的试验中,IMU-838与安慰剂相比没有增加感染率。此外,DHODH抑制剂,如IMU-838,已知具有基于宿主的抗病毒作用,这种作用与特定病毒蛋白及其结构无关。因此,DHODH抑制可广泛应用于多种病毒。在2017年,IMU-828的2项I期临床试验获得了成功。
除了开发IMU-838用于治疗RRMS患者之外,Immunic公司也正在开展多项II期临床试验,评估IMU-838治疗新型冠状病毒肺炎(COVID-19)、原发性硬化性胆管炎(PSC)、溃疡性结肠炎(UC),数据预计在未来几个月公布。
IMU-838结构式及DHODH抑制(点击图片查看大图)
EMPhASIS是一项国际性、多中心、双盲、安慰剂对照、随机、平行组研究,旨在评估IMU-838治疗RRMS患者的疗效和安全性。在欧洲四个国家36个中心入组的210名患者中,209名患者接受了至少一剂IMU-838或安慰剂(安慰剂组n=69;30mg IMU-838组n=71;45mg IMU-838组n=69,每日口服一次),197名患者完成了为期24周的盲法治疗。根据复发的临床证据和其他磁共振成像(MRI)标准,所有入组患者都必须显示疾病活动性。主要终点和关键次要终点分别是:IMU-838 45mg组和30mg组在盲法治疗24周内合并独立活动性(CUA)磁共振成像(MRI)病灶的累积数量。在基线检查时和第6、12、18和24周进行MRI检查,并由一个独立盲法MRI阅读者进行集中评估。这项研究包括一个可选的长达9.5年的延长治疗期,以评估IMU-838的长期安全性和耐受性。
如前所述,该研究达到了主要终点:治疗24周内,与安慰剂组相比,45mg剂量组患者合并独立活动性磁共振成像((CUA-MRI)病灶的累积数量显著减少62%(p=0.0002)。该研究也达到了关键次要终点:与安慰剂组相比,30mg剂量组患者的CUA-MRI病灶累积数量显著减少70%(p<0.0001)。全部其他次要终点方面,包括基于其他MRI参数和临床终点(如复发事件)的次要终点,与安慰剂组相比,2种剂量IMU-838治疗组显示出了明显的信号和数值效益。
对完整非盲数据集的亚组分析显示,不同人群的MRI病灶抑制效果一致,包括治疗效果独立于研究前治疗(既往未接受治疗[初治]或接受过治疗[经治])、研究前复发次数或入组国家。此外,MRI病灶抑制的时间进程表明,在试验的第一个评估时间点(第6周),已经出现病灶的减少,这与之前IMU-838快速达到稳定的治疗药物水平一致。
MRI效果以外的其他次要终点,如复发活动或扩大残疾状态量表(EDSS)的变化(一种衡量患者神经状态的方法)显示,与安慰剂相比,IMU-838治疗组在首次复发时间和年化复发率方面有优势,尽管这项研究的持续时间太短,无法提供正式评估。这表明,在随访时间更长的未来研究中,IMU-838治疗组的MRI活动可能转化为临床复发相关终点的活动,这也得到了RRMS其他试验的第三方meta分析的支持。
与基线值相比,第24周时,IMU-838的两个治疗组的血清神经丝显著下降(30mg组为-17.0%,45mg为-20.5%),而安慰剂组的患者在同一时间血清神经丝小幅增加了6.5%。血清神经丝轻链(sNfL,一种轴突损伤的生物标志物)的减少,已经被证明与神经退行性变和神经炎症过程相关,在过去的几年里,它已经成为MS最重要的血清生物标志物之一。
与之前发布的顶线结果一致,完整的非盲数据集也证实,IMU-838总体上耐受性良好,其安全性与安慰剂相似。最常见的治疗期间出现的不良事件(TEAE)是头痛和鼻咽炎,在IMU-838和安慰剂治疗的患者中,发生率超过5%。不良事件(AE)一般为轻度,只发生了一例严重强度的不良事件(安慰剂组)。在该研究中,只有3例患者出现严重不良事件,一例在安慰剂组(宫颈癌)、2例在IMU-838治疗组(开放性骨折、输尿管结石/肾积水)。AE报告中没有任何肝毒性信号,这是通过一项详细的分析证实的,该分析表明,对肝酶和胆红素没有普遍影响。IMU-838对血液学指标无明显影响,无中性粒细胞减少、白细胞减少或淋巴细胞减少。该研究中,每种剂量IMU-838均未显示出对血清尿酸水平的普遍影响或血尿发生率的增加。在24周的盲法治疗期间,IMU-838治疗组的退出率仅为4.3%,而安慰剂组为7.2%。
Immunic首席医疗官Andreas Muehler医学博士指出:“完整的研究数据大大增强了我们对IMU-838作为RRMS新型口服治疗选择潜力的信心。特别是,研究结果表明,2种剂量的IMU-838在所有与疗效相关的测量和生物标记物时都是同样有效的,而且这2种剂量都不存在任何安全性问题,这将是一个重要的区分因子。从本试验的全剂量分析来看,我们认为30mg/天是最适合的剂量,可用于仍在试验中的患者的延长治疗。”(生物谷Bioon.com)
原文出处:Immunic, Inc. Publishes Full Unblinded Clinical Data From Phase 2 EMPhASIS Trial of IMU-838 in Patients With Relapsing-Remitting Multiple Sclerosis and Announces Poster Presentation at the MSVirtual2020
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->