Science:我国科学家发现人中和抗体结合SARS-CoV-2刺突蛋白的N端结构域
来源:本站原创 2020-06-25 23:59
2020年6月25日讯/生物谷BIOON/---COVID-19在全球范围内的爆发已成为对人类健康的严重威胁。COVID-19是由新型冠状病毒SARS-CoV-2引起的。这种病毒是一种正链包膜RNA病毒,可引起人类咳嗽、头痛、呼吸困难、肌痛、发热和严重肺炎等症状。SARS-CoV-2是β冠状病毒属的成员,分别在2002年和2012年引起流行病的SARS-Co
2020年6月25日讯/生物谷BIOON/---COVID-19疫情在全球范围内的爆发已成为对人类健康的严重威胁。COVID-19是由新型冠状病毒SARS-CoV-2引起的。这种病毒是一种正链包膜RNA病毒,可引起人类咳嗽、头痛、呼吸困难、肌痛、发热和严重肺炎等症状。
SARS-CoV-2是β冠状病毒属的成员,分别在2002年和2012年引起流行病的SARS-CoV和MERS-CoV也属于β冠状病毒。SARS-CoV-2与SARS-CoV具有大约80%的序列一致性,并使用相同的细胞受体---血管紧张素转换酶2(ACE2)---进入宿主细胞。
三聚体刺突蛋白(S蛋白)装饰着冠状病毒的表面,在病毒进入过程中起着关键作用。在感染过程中,S蛋白被宿主蛋白酶(比如TMPRSS2)切割成N端的S1亚基和C端的S2亚基,并从融合前状态转变为融合后状态。S1和S2由胞外结构域(ECD,1-1208个氨基酸)和单个跨膜螺旋组成,分别介导受体结合和膜融合。S1由N端结构域(NTD)和受体结合结构域(RBD)组成,对决定组织嗜性和宿主范围至关重要。RBD负责与ACE2结合,而NTD的功能尚不十分清楚。在一些冠状病毒中,NTD可能在初始附着时识别特定的糖基团,并可能在S蛋白从融合前状态到融合后状态的转变中发挥重要作用。MERS-CoV S蛋白的NTD可以作为中和抗体的关键表位。
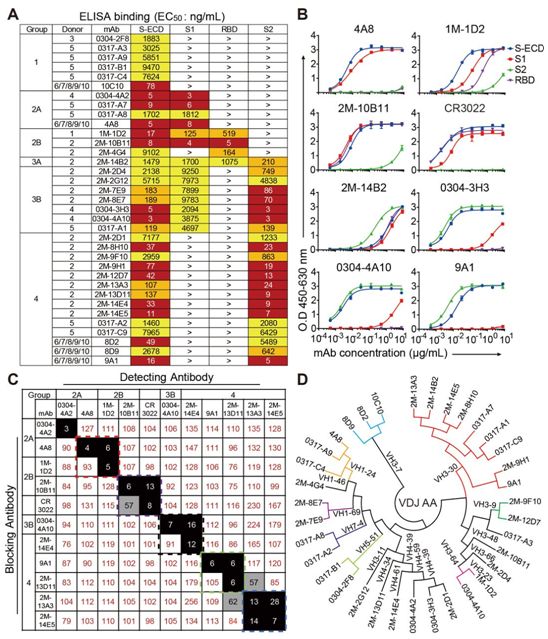
具有强效中和活性的靶向SARS-CoV-2 S蛋白的单克隆抗体(mAb)是开发COVID-19治疗干预的一个重点。许多研究报道了靶向RBD和抑制S蛋白与ACE2之间结合的SARS-CoV-2中和抗体的功能和结构。使用单一的RBD靶向抗体可能会诱发冠状病毒产生抵抗性突变。靶向非RBD表位的抗体可能被添加到针对SARS-CoV-2的抗体组合疗法中。
不仅位于S蛋白的RBD上的表位分布,而且位于整个S蛋白上的表位分布都可用来指导开发靶向SARS-CoV-2的治疗性药物。在一项新的研究中,来自中国军事医学科学院、西湖大学和清华大学的研究人员从10名康复期COVID-19患者中分离并描述了mAb。相关研究结果于2020年6月22日在线发表在Science期刊上,论文标题为“A neutralizing human antibody binds to the N-terminal domain of the Spike protein of SARS-CoV-2”。
他们分离出的三种mAb显示出对真正的SARS-CoV-2的中和活性。一种名为4A8的mAb对真正的SARS-CoV-2和SARS-CoV-2假病毒都有较高的中和效力,但并不结合RBD。他们解析出4A8与S蛋白结合在一起时的总体分辨率为3.1埃的低温电镜结构和针对4A8-NTD界面的局部分辨率为3.3埃的低温电镜结构,从而确定4A8的表位为S蛋白的NTD。这表明NTD是针对COVID-19的治疗性mAb的一个有希望的靶点。
鉴于COVID-19大流行仍在持续,迫切需要对SARS-CoV-2感染进行预防和治疗干预。这项研究揭示从10名康复期患者的B细胞中分离出的天然存在的人类SARS-CoV-2 mAb在基因使用和S蛋白的表位识别方面具有多样性。值得注意的是,大多数分离的mAb并不识别RBD,而且所有中和真正的SARS-CoV-2的mAb都不能抑制S蛋白与ACE2的结合。这些出乎意料的结果表明,除了抑制这种冠状病毒与ACE2的相互作用外,还存在其他重要的SARS-CoV-2中和机制。
靶向S1的mAb 4A8不能阻断ACE2与S蛋白之间的相互作用,但是在体外对真正的SARS-CoV-2和SARS-CoV-2假病毒均表现出高水平的中和作用。据报道,许多靶向SARS-CoV-2的中和抗体都是以S蛋白的RBD为靶点,阻断RBD和ACE2之间的结合。这项研究的结果表明4A8与S蛋白的NTD结合,具有强效的中和活性。之前的研究已表明,mAb 7D10很可能是通过抑制RBD-DPP4结合和S蛋白从融合前状态到融合后状态的构象变化来与MERS-CoV S蛋白的NTD结合。这些研究人员将7D10与MERS-CoV S蛋白的NTD结合在一起时的晶体结构与4A8-S蛋白复合物结构进行了比较,发现这种mAb与NTD之间的界面有部分重叠。7D10可能通过它靠近RBD的轻链抑制MERS-CoV和DPP4之间的相互作用。在这种4A8-S蛋白复合物中,4A8的轻链远离RBD。因此,他们推测4A8可能通过抑制S蛋白的构象变化来中和SARS-CoV-2。此外,SARS-CoV-2、SARS-CoV和MERS-CoV S蛋白的序列比对显示了可分别被不同mAb所识别的不同NTD表面序列。
总的来说,这项研究报道了一种识别SARS-CoV-2 S蛋白上脆弱的NTD表位的全人中和mAb,它的作用机制与受体结合抑制无关。4A8与RBD靶向抗体的结合可能会避免这种病毒的逃逸突变,成为有前景的抗体组合疗法。这项研究获得的信息可用于开发基于结构的SARS-CoV-2疫苗设计。(生物谷 Bioon.com)
参考资料:
Xiangyang Chi et al. A neutralizing human antibody binds to the N-terminal domain of the Spike protein of SARS-CoV-2. Science, 2020, doi:10.1126/science.abc6952.
SARS-CoV-2是β冠状病毒属的成员,分别在2002年和2012年引起流行病的SARS-CoV和MERS-CoV也属于β冠状病毒。SARS-CoV-2与SARS-CoV具有大约80%的序列一致性,并使用相同的细胞受体---血管紧张素转换酶2(ACE2)---进入宿主细胞。
三聚体刺突蛋白(S蛋白)装饰着冠状病毒的表面,在病毒进入过程中起着关键作用。在感染过程中,S蛋白被宿主蛋白酶(比如TMPRSS2)切割成N端的S1亚基和C端的S2亚基,并从融合前状态转变为融合后状态。S1和S2由胞外结构域(ECD,1-1208个氨基酸)和单个跨膜螺旋组成,分别介导受体结合和膜融合。S1由N端结构域(NTD)和受体结合结构域(RBD)组成,对决定组织嗜性和宿主范围至关重要。RBD负责与ACE2结合,而NTD的功能尚不十分清楚。在一些冠状病毒中,NTD可能在初始附着时识别特定的糖基团,并可能在S蛋白从融合前状态到融合后状态的转变中发挥重要作用。MERS-CoV S蛋白的NTD可以作为中和抗体的关键表位。

图片来自Science, 2020, doi:10.1126/science.abc6952。
具有强效中和活性的靶向SARS-CoV-2 S蛋白的单克隆抗体(mAb)是开发COVID-19治疗干预的一个重点。许多研究报道了靶向RBD和抑制S蛋白与ACE2之间结合的SARS-CoV-2中和抗体的功能和结构。使用单一的RBD靶向抗体可能会诱发冠状病毒产生抵抗性突变。靶向非RBD表位的抗体可能被添加到针对SARS-CoV-2的抗体组合疗法中。
不仅位于S蛋白的RBD上的表位分布,而且位于整个S蛋白上的表位分布都可用来指导开发靶向SARS-CoV-2的治疗性药物。在一项新的研究中,来自中国军事医学科学院、西湖大学和清华大学的研究人员从10名康复期COVID-19患者中分离并描述了mAb。相关研究结果于2020年6月22日在线发表在Science期刊上,论文标题为“A neutralizing human antibody binds to the N-terminal domain of the Spike protein of SARS-CoV-2”。
他们分离出的三种mAb显示出对真正的SARS-CoV-2的中和活性。一种名为4A8的mAb对真正的SARS-CoV-2和SARS-CoV-2假病毒都有较高的中和效力,但并不结合RBD。他们解析出4A8与S蛋白结合在一起时的总体分辨率为3.1埃的低温电镜结构和针对4A8-NTD界面的局部分辨率为3.3埃的低温电镜结构,从而确定4A8的表位为S蛋白的NTD。这表明NTD是针对COVID-19的治疗性mAb的一个有希望的靶点。
鉴于COVID-19大流行仍在持续,迫切需要对SARS-CoV-2感染进行预防和治疗干预。这项研究揭示从10名康复期患者的B细胞中分离出的天然存在的人类SARS-CoV-2 mAb在基因使用和S蛋白的表位识别方面具有多样性。值得注意的是,大多数分离的mAb并不识别RBD,而且所有中和真正的SARS-CoV-2的mAb都不能抑制S蛋白与ACE2的结合。这些出乎意料的结果表明,除了抑制这种冠状病毒与ACE2的相互作用外,还存在其他重要的SARS-CoV-2中和机制。
靶向S1的mAb 4A8不能阻断ACE2与S蛋白之间的相互作用,但是在体外对真正的SARS-CoV-2和SARS-CoV-2假病毒均表现出高水平的中和作用。据报道,许多靶向SARS-CoV-2的中和抗体都是以S蛋白的RBD为靶点,阻断RBD和ACE2之间的结合。这项研究的结果表明4A8与S蛋白的NTD结合,具有强效的中和活性。之前的研究已表明,mAb 7D10很可能是通过抑制RBD-DPP4结合和S蛋白从融合前状态到融合后状态的构象变化来与MERS-CoV S蛋白的NTD结合。这些研究人员将7D10与MERS-CoV S蛋白的NTD结合在一起时的晶体结构与4A8-S蛋白复合物结构进行了比较,发现这种mAb与NTD之间的界面有部分重叠。7D10可能通过它靠近RBD的轻链抑制MERS-CoV和DPP4之间的相互作用。在这种4A8-S蛋白复合物中,4A8的轻链远离RBD。因此,他们推测4A8可能通过抑制S蛋白的构象变化来中和SARS-CoV-2。此外,SARS-CoV-2、SARS-CoV和MERS-CoV S蛋白的序列比对显示了可分别被不同mAb所识别的不同NTD表面序列。
总的来说,这项研究报道了一种识别SARS-CoV-2 S蛋白上脆弱的NTD表位的全人中和mAb,它的作用机制与受体结合抑制无关。4A8与RBD靶向抗体的结合可能会避免这种病毒的逃逸突变,成为有前景的抗体组合疗法。这项研究获得的信息可用于开发基于结构的SARS-CoV-2疫苗设计。(生物谷 Bioon.com)
参考资料:
Xiangyang Chi et al. A neutralizing human antibody binds to the N-terminal domain of the Spike protein of SARS-CoV-2. Science, 2020, doi:10.1126/science.abc6952.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


