全文编译!我国科学家从结构上揭示瑞德西韦抑制新冠病毒RNA依赖性RNA聚合酶机制
来源:本站原创 2020-05-23 19:03
2020年5月23日讯/生物谷BIOON/---由SARS-CoV-2病毒引起的COVID-19大流行已成为一场人道主义危机,截至2020年4月8日报告的感染人数超过150万,死亡人数超过8.7万,到2020年4月27日已迅速增加到感染人数超过299万和死亡人数20.7万。SARS-CoV-2与严重急性呼吸综合征冠状病毒(SARS-CoV)和β冠状病毒家族中
2020年5月23日讯/生物谷BIOON/---由SARS-CoV-2病毒引起的COVID-19大流行已成为一场人道主义危机,截至2020年4月8日报告的感染人数超过150万,死亡人数超过8.7万,到2020年4月27日已迅速增加到感染人数超过299万和死亡人数20.7万。SARS-CoV-2与严重急性呼吸综合征冠状病毒(SARS-CoV)和β冠状病毒家族中的几个成员(包括蝙蝠冠状病毒和穿山甲冠状病毒)密切相关。可能是由于SARS-CoV-2病毒刺突蛋白与宿主受体的结合亲和力较强,SARS-CoV-2在人与人之间的传播率要高得多,从而导致全球范围内的感染。
SARS-CoV-2是一种正链RNA病毒。它的复制是由病毒非结构蛋白(nsp)的多亚基复制/转录复合物介导的。这种复合物的核心成分是RNA依赖性RNA聚合酶(RdRp)的催化亚基(nsp12)。nsp12本身几乎没有什么活性,其功能需要包括nsp7和nsp8在内的辅助因子,这些辅助因子可以增加RdRp的模板结合和持续合成能力。RdRp也被提出是一类称为核苷酸类似物的抗病毒药物---包括瑞德西韦(remdesivir, 也称为GS-5734)---的靶点,其中瑞德西韦是一种前体药物,在细胞内可转化为三磷酸形式的活性药物。因此,RdRp一直是结构生物学研究的重点。科学家们已解析出nsp7、nsp8以及nsp12-nsp7-nsp8复合物的结构,并提供了RdRp复合物的整体结构。然而,由于没有SARS-CoV-2 RdRp与RNA模板或核苷酸抑制剂所形成的复合物的结构,药物发现工作受到阻碍。
在一项新的研究中,来自中国科学院、浙江大学、清华大学、北京协和医院、无锡佰翱得生物科学有限公司、上海交通大学和浙江省免疫与炎症疾病重点实验室的研究人员解析出SARS-CoV-2 RdRp复合物在apo形式(apo form)下以及与模板-引物RNA和抗病毒药物瑞德西韦(Remdesivir)结合在一起时的两种低温电镜结构。相关研究结果近期发表在Science期刊上,论文标题为“Structural basis for inhibition of the RNA-dependent RNA polymerase from SARS-CoV-2 by remdesivir”。
为了开展低温电镜研究,这些研究人员将nsp12与nsp7和nsp8在昆虫细胞中共表达,从而形成核心RdRp复合物(图1A)。nsp7和nsp8的化学计量比似乎小于nsp12,因此,在最后的纯化步骤之前,补充了额外的细菌表达的nsp7和nsp8,以提高异源三聚体复合物的产量。纯化的nsp12在与长50个碱基的部分双链模板-引物RNA的结合上表现出很小的活性(图1B),这与SARS-CoV的nsp12相类似。nsp7和nsp8的存在显著增加了nsp12与模板-引物RNA的结合。在加入三磷酸腺苷(ATP)后,nsp12-nsp7-nsp8复合物在聚尿嘧啶模板上也表现出RNA聚合活性(图1,B和C)。这种RNA聚合活性可被加入的瑞德西韦的活性三磷酸形式(triphosphate form of Remdesivir, RTP)有效抑制(图1D)。即使在10 mM ATP的存在下,1 mM RTP也完全抑制了RdRp的聚合活性。相比之下,作为一种前体药物,瑞德西韦在5 mM浓度下,对这种纯化的RdRp酶的聚合活性没有任何抑制作用,瑞德西韦的单磷酸形式(Remdesivir in its monophosphate form, RMP)也没有这种抑制能力。
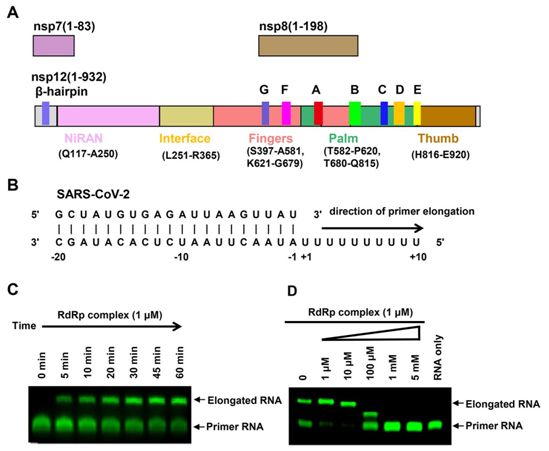
纯化的RdRp复合物在53℃的解链温度下相对稳定。nsp12-nsp7-nsp8复合物的阴性染色电镜可视化观察显示出具有良好均匀性的分散颗粒。对于apo形式下的nsp12-nsp7-nsp8复合物,这些研究人员在洗涤剂DDM的存在下,对这种复合物样本进行了玻璃化处理。对图像处理的初步尝试显示,这些颗粒是优先取向的。因此,他们收集了超过570万个颗粒的7400多个显微影像,以增加非优先取向的投影数量。其中,81494个颗粒被用于产生2.8埃分辨率的密度图。
nsp12-nsp7-nsp8与模板-引物RNA和RTP结合在一起(称为template-RTP RdRp复合物)时的低温电镜研究面临两个挑战。首先,大多数颗粒被吸附到低温电镜网栅条上,而不是停留在玻璃态冰中。其次,在低温电镜样本制备的条件下,RNA双链可能从template-RTP RdRp复合物中解离下来。最终,这些研究人员制备出15mg/ml的template-RTP RdRp复合物样本用于低温电镜实验,这一浓度远高于可溶性蛋白复合物在低温电镜研究时所使用的正常浓度。这种template-RTP RdRp复合物的高浓度具有质量作用效应,以稳定这种RNA-蛋白复合物,并且让过量的template-RTP RdRp复合物逃避低温电镜网栅条的吸收,从而进入玻璃态冰中。他们收集了2886个显微影像,从而利用130386个颗粒投影产生了2.5埃分辨率的结构。由于这种解析出的结构的相对较高的分辨率,这种低温电镜图清晰地显示了这种复合物的关键结构特征。
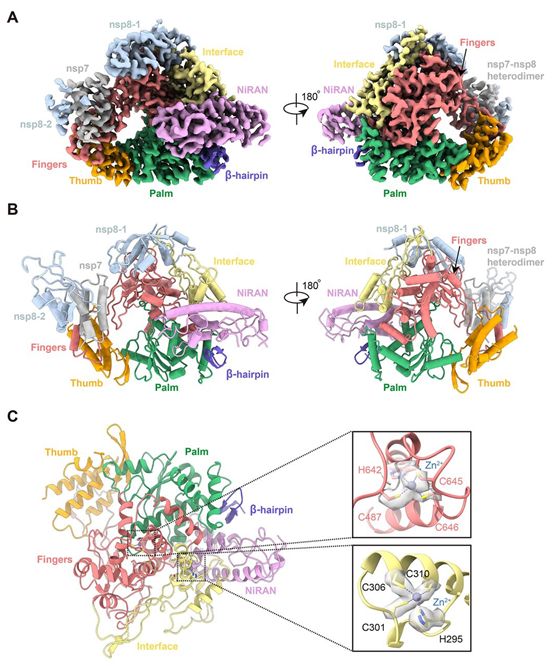
RdRp复合物在apo形式下的结构包含一个nsp12、一个nsp7和两个nsp8,整体排列与SARS-CoV和最近解析出的SARS-CoV-2中的结构相类似(图2,A和B)。与SARS-CoV RdRp结构不同但与最近解析出的SARS-CoV-2 RdRp结构相似的是,这种结构显示nsp12还包含一个N末端的β-发夹(残基31~50)和一个延伸的套病毒RdRp相关核苷酰转移酶结构域(NiRAN,残基115-250),此外还有7个螺旋和3个β链。在NiRAN结构域之后是一个由3个螺旋和5个β链组成的界面结构域(残基251-365),该界面结构域与RdRp结构域(残基366-920)相连(图1A和2B)。nsp12的RdRp结构域显示出典型的杯状右手构象,手指亚结构域(残基397-581和残基621-679)与拇指亚结构域(残基819-920)形成一个封闭的环形结构(图2,A和B)。这种封闭构象通过nsp7和nsp8的结合而变得稳定,其中一个nsp8分子位于手指亚结构域的顶部,并与界面结构域相互作用。nsp12的封闭构象可通过nsp7-nsp8异源二聚体进一步稳定化,这种异源二聚体沿着拇指-手指亚结构域界面堆积(图2,A和B)。此外,这些研究人员能够在由H295-C301-C306-C310和C487-H642-C645-C646组成的保守性金属结合基序中配位两个锌离子(图2C),这一点在SARS-CoV RdRp结构中也能观察到。这些锌离子很可能是维护RdRp结构完整性的保守结构成分。
template-RTP RdRp复合物的结构包含一个nsp12、一个nsp7和一个nsp8(图3,A和B)。第二个nsp8在template-RTP复合物的低温电镜图中基本看不到,因此没有包含在最终的结构模型中。此外,template-RTP RdRp结构含有位于模板链中的长14个碱基的RNA,位于引物链中的长11个碱基的RNA、与引物链共价连接在一起的抑制剂RMP(图3,C和D),以及一个焦磷酸和三个镁离子,这些镁离子可能作为活性位点附近的催化离子(图3D)。
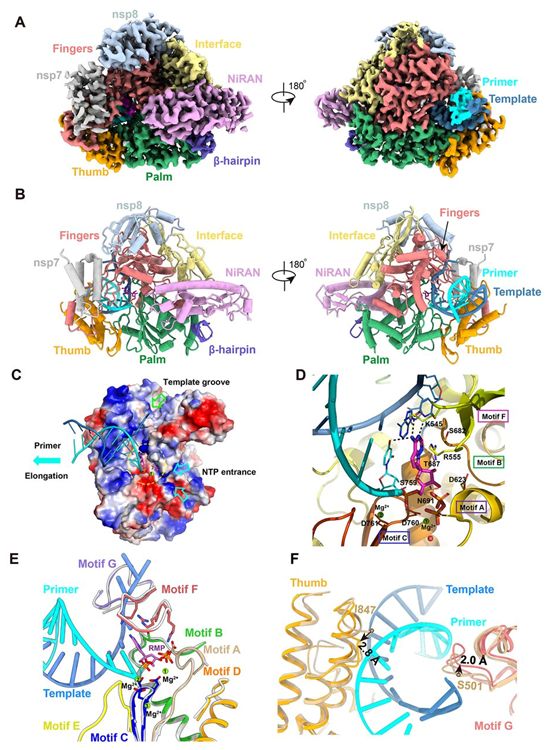
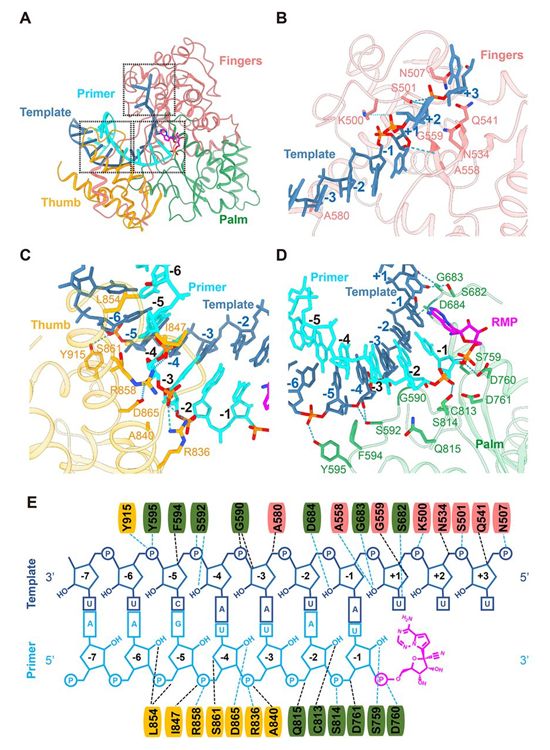
template-RTP RdRp复合物的整体结构与apo形式下的RdRp结构相似,nsp12处于封闭构象(图2A和3A)。由来自模板-引物RNA的11个碱基对形成的双链RNA螺旋(图3C和4,A至E),由手指-手掌-拇指亚结构域握着。在模板-引物RNA和nsp12之间观察到广泛的蛋白-RNA相互作用,共有29个来自nsp12的残基直接参与RNA的结合(图4E)。令人惊讶的是,尽管nsp7和nsp8这两种蛋白是RdRp结合RNA所需要的,但是它们并不介导RNA相互作用。大多数蛋白-RNA相互作用涉及RNA磷酸-核糖骨架,许多相互作用直接发生在2′-OH基团上(图4E),从而为区分RNA与DNA提供了基础。nsp12与模板-引物RNA的任何碱基对都没有接触,这表明序列独立于DNA的生物碱基对。nsp12与模板-引物RNA的任何碱基对都没有接触,这表明RdRp与RNA的结合与序列无关。这与RdRp在延伸阶段的酶活性不需要特定的序列这一事实是一致的。
位于引物链的3′端是RMP(图3D和图4,D和E),RMP在+1位点共价整合到引物链上(图4E)。在模板链的+2和+3位点上的核苷酸与来自手指亚结构域背面的残基相互作用(图4,A和B)。尽管在复合物组装中存在过量的RTP,但从这种复合物结构中观察到,只有单一的RMP被组装到引物链上。因此,瑞德西韦和许多核苷酸类似物前体药物一样,通过非专一性RNA链终止机制抑制病毒RdRp活性,这一机制需要瑞德西韦转化为它的活性三磷酸形式。
RMP的结合位置位于催化活性位点的中心(图3D)。作为一种单磷酸腺苷类似物,RMP与来自引物链的上游碱基形成碱基堆积相互作用,并且与来自模板链的尿苷碱基形成两个氢键(图3D)。此外,RMP还与K545和R555的侧链发生相互作用。在结合的RMP附近有两个镁离子和一个焦磷酸。这两个镁离子与磷酸二酯骨架相互作用,它们是催化活性位点的一部分。焦磷酸位于活性位点的核苷酸进入通道的通道口,可能阻断核苷酸三磷酸进入活性侧(图3,C和D)。
nsp12 RdRp的催化活性位点由A到G的7个保守性基序构成(图1A和3E)。来自手掌亚结构域的基序ABCD和基序C中的SDD序列(残基759-761)形成催化活性中心(图3D)。D760和D761都参与了催化中心中的两个镁离子的配位。基序F和G位于手指亚结构域内,它们与模板链RNA相互作用,并引导该链进入活性位点(图3E)。基序F中与+1碱基相接触的K545和R555侧链与引物链RNA相互作用(图3D),从而将进入的核苷酸稳定在正确的位置上进行催化。模板-引物RNA在活性位点中的的定位类似于模板-引物RNA在脊髓灰质炎病毒RdRp延伸复合物和HCV NS5B RdRp抑制复合物中的定位。参与RNA结合的残基以及包含催化活性位点的残基都是高度保守的,这突出了RdRp在这些不同的RNA病毒中的保守性基因组复制机制,并表明有可能开发出广谱抗病毒抑制剂,如瑞德西韦和加利德韦(galidesivir, 也称为BCX4430)。
结构比较发现了apo形式下的RdRp复合物和template-RTP RdRp复合物结构之间的几个有趣的差异(图3,E和F)。首先,nsp7向RdRp核心移动了1.5埃(如nsp7残基F49所测得的那样),导致界面重排,结果就是复合物中第二个nsp8的结合力减弱。第二,连接拇指亚结构域的第一螺旋和第二螺旋的环状结构向外移动了2.8埃(如nsp12残基I847所测得的那样),以容纳双链RNA螺旋的结合(图3F)。第三,基序G残基K500和S501也向外移动2.0埃,以容纳模板链RNA的结合。除了这些变化之外,apo形式下的nsp12和template-RTP RdRp复合物中的nsp12非常相似:整个蛋白中所有Cα原子的均方根偏差(root mean square deviation, rmsd)为0.52埃。特别是构成催化活性位点的结构元素可以完全叠加(图3E),这表明SARS-CoV-2 RdRp是一种相对稳定的酶,当与RNA模板结合后,就可以发挥复制酶的功能。病毒RdRp是一种高度进行性的酶,其复制速度可达100个核苷酸/秒。apo形式下的结构和活性酶结构之间没有明显的构象变化,这与病毒RNA聚合酶的较高持续合成能力相一致,因而在复制周期中不需要消耗额外能量来导致活性位点发生构象变化。
除了瑞德西韦之外,一些核苷酸类似物药物,包括法匹拉韦(Favipavirir)、利巴韦林(Ribavirin)、加利德韦(galidesivir)和EIDD-2801,在细胞实验中有效地抑制SARS-CoV-2复制。与瑞德西韦一样,这些核苷酸类似物也被提出通过非专一性RNA链终止机制抑制病毒RdRp,这种机制需要前体化合物转化为它们的三磷酸活性形式。template-RTP RdRp复合物的结构提供了一个很好的模型来合理地思考这些药物如何抑制SARS-CoV-2 RdRp活性。特别是,EIDD-2801在阻断SARS-CoV-2复制方面比瑞德西韦强3~10倍。胞苷环外的N4羟基与K545的侧链形成一个额外的氢键,而胞苷碱基也与模板链上的鸟嘌呤碱基形成一个额外的氢键。这两个额外的氢键可能解释了EIDD-2801在抑制SARS-CoV-2复制方面具有明显更高的效力。
COVID-19大流行已经在全球范围内造成了情感上的痛苦和经济负担。对病毒生命周期至关重要的酶,因其与宿主蛋白不同,是很好的抗病毒药物靶点。在病毒酶中,RdRp是现有许多核苷酸类药物的主要靶点。在这篇论文中,这些研究人员报道了SARS-CoV-2 RdRp复合物的apo形式以及与模板-引物RNA和活性形式的雷德西韦结合在一起时的结构。这些结构揭示了模板-引物RNA是如何被这种酶识别的,以及瑞德西韦如何抑制链的延伸。结构比较和序列比对表明,RdRp识别底物RNA和瑞德西韦抑制RdRp的模式在不同的RNA病毒中高度保守,这为设计基于核苷酸类似物的广谱抗病毒药物提供了基础。此外,这些结构为现有的核苷酸类药物(包括强效的EIDD-2801)的建模和修饰提供了一个坚实的模板。总之,这些观察结果为设计更强效的抑制剂来对抗SARS-CoV-2的恶性感染提供了合理的基础。(生物谷 Bioon.com)
参考资料:
Wanchao Yin et al. Structural basis for inhibition of the RNA-dependent RNA polymerase from SARS-CoV-2 by remdesivir. Science, 2020, doi:10.1126/science.abc1560.
SARS-CoV-2是一种正链RNA病毒。它的复制是由病毒非结构蛋白(nsp)的多亚基复制/转录复合物介导的。这种复合物的核心成分是RNA依赖性RNA聚合酶(RdRp)的催化亚基(nsp12)。nsp12本身几乎没有什么活性,其功能需要包括nsp7和nsp8在内的辅助因子,这些辅助因子可以增加RdRp的模板结合和持续合成能力。RdRp也被提出是一类称为核苷酸类似物的抗病毒药物---包括瑞德西韦(remdesivir, 也称为GS-5734)---的靶点,其中瑞德西韦是一种前体药物,在细胞内可转化为三磷酸形式的活性药物。因此,RdRp一直是结构生物学研究的重点。科学家们已解析出nsp7、nsp8以及nsp12-nsp7-nsp8复合物的结构,并提供了RdRp复合物的整体结构。然而,由于没有SARS-CoV-2 RdRp与RNA模板或核苷酸抑制剂所形成的复合物的结构,药物发现工作受到阻碍。
在一项新的研究中,来自中国科学院、浙江大学、清华大学、北京协和医院、无锡佰翱得生物科学有限公司、上海交通大学和浙江省免疫与炎症疾病重点实验室的研究人员解析出SARS-CoV-2 RdRp复合物在apo形式(apo form)下以及与模板-引物RNA和抗病毒药物瑞德西韦(Remdesivir)结合在一起时的两种低温电镜结构。相关研究结果近期发表在Science期刊上,论文标题为“Structural basis for inhibition of the RNA-dependent RNA polymerase from SARS-CoV-2 by remdesivir”。
为了开展低温电镜研究,这些研究人员将nsp12与nsp7和nsp8在昆虫细胞中共表达,从而形成核心RdRp复合物(图1A)。nsp7和nsp8的化学计量比似乎小于nsp12,因此,在最后的纯化步骤之前,补充了额外的细菌表达的nsp7和nsp8,以提高异源三聚体复合物的产量。纯化的nsp12在与长50个碱基的部分双链模板-引物RNA的结合上表现出很小的活性(图1B),这与SARS-CoV的nsp12相类似。nsp7和nsp8的存在显著增加了nsp12与模板-引物RNA的结合。在加入三磷酸腺苷(ATP)后,nsp12-nsp7-nsp8复合物在聚尿嘧啶模板上也表现出RNA聚合活性(图1,B和C)。这种RNA聚合活性可被加入的瑞德西韦的活性三磷酸形式(triphosphate form of Remdesivir, RTP)有效抑制(图1D)。即使在10 mM ATP的存在下,1 mM RTP也完全抑制了RdRp的聚合活性。相比之下,作为一种前体药物,瑞德西韦在5 mM浓度下,对这种纯化的RdRp酶的聚合活性没有任何抑制作用,瑞德西韦的单磷酸形式(Remdesivir in its monophosphate form, RMP)也没有这种抑制能力。

图1.nsp12-nsp-7-nsp8 RdRp活性复合物的组装以及瑞德西韦对它的抑制作用。
纯化的RdRp复合物在53℃的解链温度下相对稳定。nsp12-nsp7-nsp8复合物的阴性染色电镜可视化观察显示出具有良好均匀性的分散颗粒。对于apo形式下的nsp12-nsp7-nsp8复合物,这些研究人员在洗涤剂DDM的存在下,对这种复合物样本进行了玻璃化处理。对图像处理的初步尝试显示,这些颗粒是优先取向的。因此,他们收集了超过570万个颗粒的7400多个显微影像,以增加非优先取向的投影数量。其中,81494个颗粒被用于产生2.8埃分辨率的密度图。
nsp12-nsp7-nsp8与模板-引物RNA和RTP结合在一起(称为template-RTP RdRp复合物)时的低温电镜研究面临两个挑战。首先,大多数颗粒被吸附到低温电镜网栅条上,而不是停留在玻璃态冰中。其次,在低温电镜样本制备的条件下,RNA双链可能从template-RTP RdRp复合物中解离下来。最终,这些研究人员制备出15mg/ml的template-RTP RdRp复合物样本用于低温电镜实验,这一浓度远高于可溶性蛋白复合物在低温电镜研究时所使用的正常浓度。这种template-RTP RdRp复合物的高浓度具有质量作用效应,以稳定这种RNA-蛋白复合物,并且让过量的template-RTP RdRp复合物逃避低温电镜网栅条的吸收,从而进入玻璃态冰中。他们收集了2886个显微影像,从而利用130386个颗粒投影产生了2.5埃分辨率的结构。由于这种解析出的结构的相对较高的分辨率,这种低温电镜图清晰地显示了这种复合物的关键结构特征。
RdRp复合物在apo形式下的结构包含一个nsp12、一个nsp7和两个nsp8,整体排列与SARS-CoV和最近解析出的SARS-CoV-2中的结构相类似(图2,A和B)。与SARS-CoV RdRp结构不同但与最近解析出的SARS-CoV-2 RdRp结构相似的是,这种结构显示nsp12还包含一个N末端的β-发夹(残基31~50)和一个延伸的套病毒RdRp相关核苷酰转移酶结构域(NiRAN,残基115-250),此外还有7个螺旋和3个β链。在NiRAN结构域之后是一个由3个螺旋和5个β链组成的界面结构域(残基251-365),该界面结构域与RdRp结构域(残基366-920)相连(图1A和2B)。nsp12的RdRp结构域显示出典型的杯状右手构象,手指亚结构域(残基397-581和残基621-679)与拇指亚结构域(残基819-920)形成一个封闭的环形结构(图2,A和B)。这种封闭构象通过nsp7和nsp8的结合而变得稳定,其中一个nsp8分子位于手指亚结构域的顶部,并与界面结构域相互作用。nsp12的封闭构象可通过nsp7-nsp8异源二聚体进一步稳定化,这种异源二聚体沿着拇指-手指亚结构域界面堆积(图2,A和B)。此外,这些研究人员能够在由H295-C301-C306-C310和C487-H642-C645-C646组成的保守性金属结合基序中配位两个锌离子(图2C),这一点在SARS-CoV RdRp结构中也能观察到。这些锌离子很可能是维护RdRp结构完整性的保守结构成分。

图2.apo形式下的nsp12-nsp-7-nsp8 RdRp复合物的低温电镜结构。
template-RTP RdRp复合物的结构包含一个nsp12、一个nsp7和一个nsp8(图3,A和B)。第二个nsp8在template-RTP复合物的低温电镜图中基本看不到,因此没有包含在最终的结构模型中。此外,template-RTP RdRp结构含有位于模板链中的长14个碱基的RNA,位于引物链中的长11个碱基的RNA、与引物链共价连接在一起的抑制剂RMP(图3,C和D),以及一个焦磷酸和三个镁离子,这些镁离子可能作为活性位点附近的催化离子(图3D)。

图3.RdRp复合物与瑞德西韦与RNA结合在一起时的低温电镜结构。
template-RTP RdRp复合物的整体结构与apo形式下的RdRp结构相似,nsp12处于封闭构象(图2A和3A)。由来自模板-引物RNA的11个碱基对形成的双链RNA螺旋(图3C和4,A至E),由手指-手掌-拇指亚结构域握着。在模板-引物RNA和nsp12之间观察到广泛的蛋白-RNA相互作用,共有29个来自nsp12的残基直接参与RNA的结合(图4E)。令人惊讶的是,尽管nsp7和nsp8这两种蛋白是RdRp结合RNA所需要的,但是它们并不介导RNA相互作用。大多数蛋白-RNA相互作用涉及RNA磷酸-核糖骨架,许多相互作用直接发生在2′-OH基团上(图4E),从而为区分RNA与DNA提供了基础。nsp12与模板-引物RNA的任何碱基对都没有接触,这表明序列独立于DNA的生物碱基对。nsp12与模板-引物RNA的任何碱基对都没有接触,这表明RdRp与RNA的结合与序列无关。这与RdRp在延伸阶段的酶活性不需要特定的序列这一事实是一致的。
位于引物链的3′端是RMP(图3D和图4,D和E),RMP在+1位点共价整合到引物链上(图4E)。在模板链的+2和+3位点上的核苷酸与来自手指亚结构域背面的残基相互作用(图4,A和B)。尽管在复合物组装中存在过量的RTP,但从这种复合物结构中观察到,只有单一的RMP被组装到引物链上。因此,瑞德西韦和许多核苷酸类似物前体药物一样,通过非专一性RNA链终止机制抑制病毒RdRp活性,这一机制需要瑞德西韦转化为它的活性三磷酸形式。

图4.RdRp复合体识别RNA。
RMP的结合位置位于催化活性位点的中心(图3D)。作为一种单磷酸腺苷类似物,RMP与来自引物链的上游碱基形成碱基堆积相互作用,并且与来自模板链的尿苷碱基形成两个氢键(图3D)。此外,RMP还与K545和R555的侧链发生相互作用。在结合的RMP附近有两个镁离子和一个焦磷酸。这两个镁离子与磷酸二酯骨架相互作用,它们是催化活性位点的一部分。焦磷酸位于活性位点的核苷酸进入通道的通道口,可能阻断核苷酸三磷酸进入活性侧(图3,C和D)。
nsp12 RdRp的催化活性位点由A到G的7个保守性基序构成(图1A和3E)。来自手掌亚结构域的基序ABCD和基序C中的SDD序列(残基759-761)形成催化活性中心(图3D)。D760和D761都参与了催化中心中的两个镁离子的配位。基序F和G位于手指亚结构域内,它们与模板链RNA相互作用,并引导该链进入活性位点(图3E)。基序F中与+1碱基相接触的K545和R555侧链与引物链RNA相互作用(图3D),从而将进入的核苷酸稳定在正确的位置上进行催化。模板-引物RNA在活性位点中的的定位类似于模板-引物RNA在脊髓灰质炎病毒RdRp延伸复合物和HCV NS5B RdRp抑制复合物中的定位。参与RNA结合的残基以及包含催化活性位点的残基都是高度保守的,这突出了RdRp在这些不同的RNA病毒中的保守性基因组复制机制,并表明有可能开发出广谱抗病毒抑制剂,如瑞德西韦和加利德韦(galidesivir, 也称为BCX4430)。
结构比较发现了apo形式下的RdRp复合物和template-RTP RdRp复合物结构之间的几个有趣的差异(图3,E和F)。首先,nsp7向RdRp核心移动了1.5埃(如nsp7残基F49所测得的那样),导致界面重排,结果就是复合物中第二个nsp8的结合力减弱。第二,连接拇指亚结构域的第一螺旋和第二螺旋的环状结构向外移动了2.8埃(如nsp12残基I847所测得的那样),以容纳双链RNA螺旋的结合(图3F)。第三,基序G残基K500和S501也向外移动2.0埃,以容纳模板链RNA的结合。除了这些变化之外,apo形式下的nsp12和template-RTP RdRp复合物中的nsp12非常相似:整个蛋白中所有Cα原子的均方根偏差(root mean square deviation, rmsd)为0.52埃。特别是构成催化活性位点的结构元素可以完全叠加(图3E),这表明SARS-CoV-2 RdRp是一种相对稳定的酶,当与RNA模板结合后,就可以发挥复制酶的功能。病毒RdRp是一种高度进行性的酶,其复制速度可达100个核苷酸/秒。apo形式下的结构和活性酶结构之间没有明显的构象变化,这与病毒RNA聚合酶的较高持续合成能力相一致,因而在复制周期中不需要消耗额外能量来导致活性位点发生构象变化。
除了瑞德西韦之外,一些核苷酸类似物药物,包括法匹拉韦(Favipavirir)、利巴韦林(Ribavirin)、加利德韦(galidesivir)和EIDD-2801,在细胞实验中有效地抑制SARS-CoV-2复制。与瑞德西韦一样,这些核苷酸类似物也被提出通过非专一性RNA链终止机制抑制病毒RdRp,这种机制需要前体化合物转化为它们的三磷酸活性形式。template-RTP RdRp复合物的结构提供了一个很好的模型来合理地思考这些药物如何抑制SARS-CoV-2 RdRp活性。特别是,EIDD-2801在阻断SARS-CoV-2复制方面比瑞德西韦强3~10倍。胞苷环外的N4羟基与K545的侧链形成一个额外的氢键,而胞苷碱基也与模板链上的鸟嘌呤碱基形成一个额外的氢键。这两个额外的氢键可能解释了EIDD-2801在抑制SARS-CoV-2复制方面具有明显更高的效力。
COVID-19大流行已经在全球范围内造成了情感上的痛苦和经济负担。对病毒生命周期至关重要的酶,因其与宿主蛋白不同,是很好的抗病毒药物靶点。在病毒酶中,RdRp是现有许多核苷酸类药物的主要靶点。在这篇论文中,这些研究人员报道了SARS-CoV-2 RdRp复合物的apo形式以及与模板-引物RNA和活性形式的雷德西韦结合在一起时的结构。这些结构揭示了模板-引物RNA是如何被这种酶识别的,以及瑞德西韦如何抑制链的延伸。结构比较和序列比对表明,RdRp识别底物RNA和瑞德西韦抑制RdRp的模式在不同的RNA病毒中高度保守,这为设计基于核苷酸类似物的广谱抗病毒药物提供了基础。此外,这些结构为现有的核苷酸类药物(包括强效的EIDD-2801)的建模和修饰提供了一个坚实的模板。总之,这些观察结果为设计更强效的抑制剂来对抗SARS-CoV-2的恶性感染提供了合理的基础。(生物谷 Bioon.com)
参考资料:
Wanchao Yin et al. Structural basis for inhibition of the RNA-dependent RNA polymerase from SARS-CoV-2 by remdesivir. Science, 2020, doi:10.1126/science.abc1560.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


