全文编译!荷兰科学家发表Science论文,在非人类灵长类动物模型中比较COVID-19、MERS和SARS的发病机制
来源:本站原创 2020-04-25 11:53
2020年4月25日讯/生物谷BIOON/---在2019年12月首次报道急性呼吸道综合征暴发后,一种称为SARS-CoV-2的新型冠状病毒就被鉴定出来。截至2020年3月14日,全世界报告的病例超过14万例,死亡超过5400例,超过了两种以前出现的冠状病毒SARS-CoV和MERS-CoV的病例总数和死亡总数。由这种病毒引起的COVID-19疾病具有多
2020年4月25日讯/生物谷BIOON/---在2019年12月首次报道急性呼吸道综合征爆发后,一种称为SARS-CoV-2的新型冠状病毒就被鉴定出来。截至2020年3月14日,全世界报告的病例超过14万例,死亡超过5400例,超过了两种以前出现的冠状病毒SARS-CoV和MERS-CoV的病例总数和死亡总数。由这种病毒引起的COVID-19疾病具有多种症状,在大多数情况下包括发烧、咳嗽、呼吸困难和肌痛。在严重的情况下,最常见的胸部计算机断层扫描(CT)发现是双侧肺受累并伴有毛玻璃样混浊(ground-glass opacity)。与2002/2003年SARS疫情爆发相似,COVID-19疾病的严重程度与年龄增加和/或合并症相关,不过严重的疾病并不局限于这些风险群体。然而,尽管有大量的病例和死亡,但是关于这种病毒感染的发病机理的信息有限。
两份关于三名COVID-19患者肺组织学检查的报告显示双侧弥漫性肺泡损伤(DAD)、肺水肿和透明膜形成,这表明存在急性呼吸窘迫综合征(ARDS)以及肺泡腔内特征性的多核巨细胞,这类似于2002/2003年SARS-CoV疫情爆发期间的调查结果。先前曾在非人类灵长类动物模型(食蟹猴)中研究过SARS-CoV感染的发病机理,在这种动物模型中,年老动物更容易患病。
在一项新的研究中,来自荷兰多家研究机构的研究人员在食蟹猴中描述了SARS-CoV-2感染的特征,并与MERS-CoV感染和SARS-CoV的历史数据进行了比较。相关研究结果于2020年4月17日在线发表在Science期刊上,论文标题为“Comparative pathogenesis of COVID-19, MERS, and SARS in a nonhuman primate model”。
首先,通过气管内(intratracheal, IT)和鼻内(intranasal, IN)联合途径给两组4只食蟹猴(一组年龄较为年轻,4~5岁;另一组年龄较大,15~20岁)接种了来自一名从中国返回的德国旅行者的SARS-CoV-2毒株。除了在接种后第14天在一只年老食蟹猴中出现了浆液性鼻液之外,在任何感染的食蟹猴中均未观察到明显的临床症状。在研究期间,在任何食蟹猴中均未观察到明显的体重减轻。到接种后第14天,鉴于血清中存在针对SARS-CoV-2病毒S1结构域和核衣壳蛋白的特异性抗体,所有剩余的食蟹猴都发生了血清转化。
作为衡量病毒脱落的一种手段,利用RT-qPCR和病毒培养法对鼻腔、咽喉和直肠拭子进行病毒检测。在鼻腔拭子中,对SARS-CoV-2 RNA的检测值在年轻食蟹猴的接种后第2天达到峰值,在年老食蟹猴的接种后第4天达到峰值;在4只食蟹猴中,有2只在接种后第8天仍可检测到SARS-CoV-2 RNA,有1只在接种后第21天仍可检测到SARS-CoV-2 RNA(图1A)。总体而言,与年轻食蟹猴相比,在年老食蟹猴的鼻腔拭子中检测到更高水平的SARS-CoV-2 RNA。
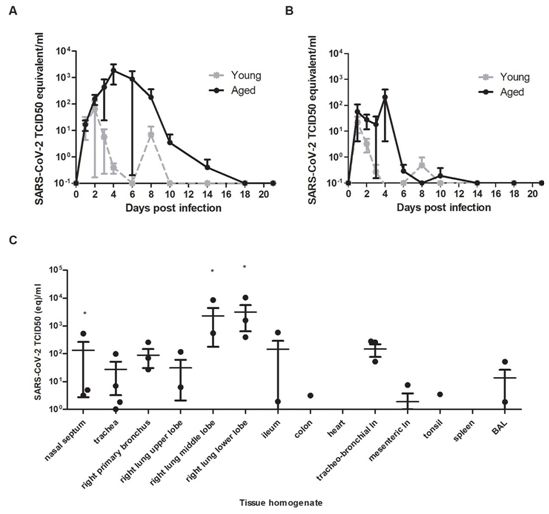
咽喉拭子中的SARS-CoV-2 RNA检测值在年轻食蟹猴接种后第1天达到高峰,而年老食蟹猴接种后第4天达到高峰,但相比于鼻腔拭子,随着时间的推移,咽喉拭子中的检测值下降得更快,不过直到接种后第10天仍可间歇性地检测到SARS-CoV-2 RNA(图1B)。分别从接种后第2天和第4天开始,利用咽喉和鼻腔拭子培养低水平的传染性病毒。为了确定这些食蟹猴脱落病毒,进行了环境采样以确定潜在的物体表面污染。环境采样表明通过隔离器内的直接接触(手)和间接污染,物体表面上存在低水平的SARS-CoV-2 RNA。在接种后第14天,仅在一只食蟹猴的直肠拭子中检测到SARS-CoV-2 RNA,此外在整个研究的任何时间点,全血中均未检测到病毒RNA。
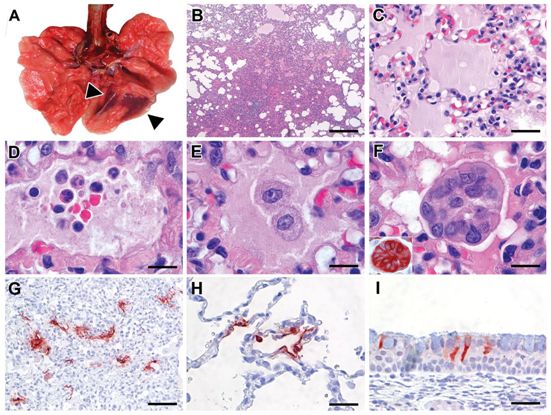
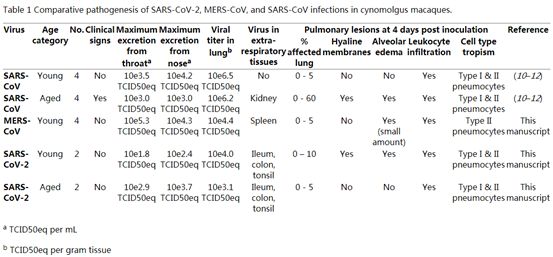
在接种后第4天对4只食蟹猴进行尸检时,两只的肺部有肺实变病灶(图2A)。第一只食蟹猴(年龄:17岁)显示出右肺中叶(占肺部组织的5%不到)实变。第二只食蟹猴(年龄:5岁)在左肺下叶(约占肺部组织的10%)有两个病灶(图2A)。肺实变组织界限清楚,呈红紫色,浮力比正常时较小。这两只食蟹猴的其他器官以及呼吸道都正常。另外两只食蟹猴均正常。
在接种后第4天通过RT-qPCR评估了来自呼吸道、消化道、泌尿道、心血管道、内分泌系统和中枢神经系统的组织以及各种淋巴组织中的病毒复制。病毒复制主要限于呼吸道(鼻腔、气管、支气管、支气管和肺叶),其中肺部SARS-CoV-2 RNA水平最高(图1C)。令人关注的是,在4只食蟹猴中,有3只的回肠和气管-支气管淋巴结中也检测到SARS-CoV-2 RNA(图1C)。
年轻和年老食蟹猴肺实变组织中的主要组织学病变涉及肺泡和细支气管,由急性或较晚期的DAD区域组成(图2B)。在这些区域中,肺泡和细支气管的管腔内不同程度地充满了富含蛋白的水肿液、纤维蛋白、细胞碎片和肺泡巨噬细胞,而中性粒细胞和淋巴细胞较少(图2C-E)。来自肺泡壁和细支气管壁的上皮大量脱落,并存在上皮坏死。在少数受损的肺泡中出现了透明膜。在病变较严重的区域,肺泡壁中度增厚并排列着立方体状的上皮细胞(II型肺细胞增生),肺泡腔空洞化。肺泡壁和支气管壁被水肿液、单核细胞和中性粒细胞增厚。肺小血管周围有淋巴细胞聚集。支气管壁的固有层和粘膜下层有适量的淋巴细胞和巨噬细胞,支气管上皮有少量中性粒细胞。上皮再生可在一些支气管中观察到:一层不规则的鳞状至高位立方体状的上皮细胞,细胞核深染。在支气管和肺泡的管腔内偶有游离的多核巨细胞(syncytia)(图2F),根据阳性的泛角蛋白染色和阴性的CD68染色,这些细胞似乎来源于上皮细胞(图2F)。
在DAD病灶内检测到中等数量的I型肺细胞和少量II型肺细胞表达SARS-CoV-2抗原(图2G,图2H)。针对它们的染色模式与受到SARS-CoV感染的食蟹猴肺部组织中的染色模式相似(阳性对照)。没有在多核巨细胞中观察到SARS-CoV-2抗原的表达。此外,在4只食蟹猴中的3只(包括2只年轻食蟹猴和1只年老食蟹猴)的所有肺叶的非病变组织中检测到SARS-CoV-2抗原表达,在少数I型和II型肺细胞、支气管纤毛上皮细胞和细支气管纤毛上皮细胞中也检测到SARS-CoV-2抗原的表达。另一只年老食蟹猴在肺部中没有SARS-CoV-2感染的病毒学或病理学证据,但是在鼻中隔、鼻甲和软腭的纤毛上皮细胞中确实有SARS-CoV-2抗原的表达,不过没有相关的组织病理变化(图2I)。在其他取样的组织(包括大脑和肠道)中,均未发现SARS-CoV抗原的表达。
为了评估与MERS-CoV相比,SARS-CoV-2感染的严重程度,这些研究人员通过气管内和鼻内联合途径给3~5岁的年轻食蟹猴接种MERS-CoV。所有食蟹猴均无临床症状。在接种后第21天,通过ELISA法检测血清中的MERS-CoV特异性抗体的存在,显示所有剩余的食蟹猴(n=2)都发生了血清转化。
分别在接种后第1~11天在鼻腔拭子(图3A)和咽喉拭子(图3B)中检测到了MERS-CoV RNA,在接种后第1天和第2天分别在鼻腔拭子和咽喉拭子检测到的MERS-CoV RNA达到峰值。在接种后的第2天和第3天,低水平(在1~85 TCID50当量/毫升之间)的MERS-CoV RNA在直肠拭子中检测到。

在接种后第4天对4只食蟹猴的尸检中,有3只存在肺实变病灶,其特征是肺部有轻微的凹陷区域,占肺部组织的5%不到(表1)。与年轻和年老食蟹猴中SARS-CoV-2感染的相类似,在接种后第4天,MERS-CoV RNA主要在接种的食蟹猴的呼吸道中检测到(图3C)。传染性MERS-CoV病毒滴度与SARS-CoV-2相似,但与年轻食蟹猴中的SARS-CoV感染相比较低(表1)。此外,在脾脏中检测到MERS-CoV RNA(表1)。
与在接种后第4天病毒在下呼吸道中的存在相一致的是,在接种的食蟹猴的肺部中观察到DAD特异性的组织病理学变化(图3D)。中性粒细胞和巨噬细胞的浸润使得肺泡隔增厚,中度II型肺细胞增生和肥大。在肺泡腔中,肺泡巨噬细胞升高,一些水肿液中含有纤维蛋白和一些中性粒细胞(图3D)。在肺泡腔中很少看到有多核巨细胞。值得注意的是,MERS-CoV抗原在接种后第4天并没有在呼吸道的任何部位检测到。因此,这些研究人员在接种后第1天的时候,对四只年轻食蟹猴进行了采样。在这时,他们观察到病毒抗原的多灶性表达主要见于II型肺细胞,偶尔见于I型肺细胞、细支气管上皮细胞和支气管上皮细胞以及一些巨噬细胞。
综上所述,这些研究人员给年轻和年老食蟹猴接种低传代的SARS-CoV-2临床分离株,在没有明显临床症状的情况下导致生产性感染。最近对人类病例的研究表明,症状前和无症状的病例也会出现病毒脱落。年龄的增加并不影响疾病的结果,但是年老动物的上呼吸道病毒脱落时间延长。在SARS-CoV-2和SARS-CoV患者中都观察到延长的病毒脱落。令人关注的是,在这项新研究的无症状动物模型中,SARS-CoV-2病毒脱落在感染过程的早期达到高峰,类似于无症状患者的情况。此外,SARS-CoV-2抗原在接种后第4天在鼻粘膜纤毛上皮细胞中检测到,但是这一点在这种动物模型的SARS-CoV或MERS-CoV感染中未观察到。
病毒的鼻粘膜嗜性与有效的呼吸道传播相吻合,这一点在甲型流感病毒中已见过。SARS-CoV-2病毒脱落在感染早期达到高峰与流感病毒脱落相似,这可能解释了为何针对SARS-CoV-2的病例检测和隔离可能不如控制SARS-CoV的有效。SARS-CoV-2主要在呼吸道组织中检测到,但在肠道等其他组织中也可检测到SARS-CoV-2 RNA,这与近期的报告相一致。最近也在接种SARS-CoV-2的恒河猴中报道了关于病毒脱落及其组织和细胞嗜性的类似结果。然而,与这新研究中的动物模型不同的是,恒河猴中的SARS-CoV-2感染确实会导致短暂的呼吸道疾病和体重下降。
在这项新的研究中,4只食蟹猴中的2只在接种后第4天出现了DAD病灶。SARS-CoV-2抗原表达和DAD的共定位为SARS-CoV-2感染引起病变提供了强有力的证据。DAD的组织学特征,包括肺泡和支气管上皮坏死、肺泡水肿、透明膜形成以及中性粒细胞、巨噬细胞和淋巴细胞聚集,与针对人类COVID-19病例的有限病理分析相吻合。特别是,肺部病变中出现多核巨细胞是呼吸道冠状病毒感染的特征。虽然MERS-CoV主要感染食蟹猴的II型肺细胞,但SARS-CoV和SARS-CoV-2也感染I型肺细胞。I型肺细胞受损可导致肺水肿和透明膜形成,这可能解释了为何透明膜形成是SARS和COVID-19的特征,但在MERS中这方面的报道不多。
这些数据表明食蟹猴对SARS-CoV-2感染较为敏感,存在长时间脱落病毒,并表现出类似COVID-19的疾病。在这种非人类灵长类动物模型中,SARS-CoV-2在整个呼吸道组织(包括鼻腔、支气管、细支气管和肺泡)的呼吸道上皮细胞中有效地复制。上呼吸道中的病毒复制与宿主之间的有效传播相吻合,而下呼吸道中的病毒复制与肺部疾病的产生相吻合。对这种模型中SARS-CoV、MERS-CoV和SARS-CoV-2感染的深入比较,可能会发现这些新兴病毒的发病机制中的关键途径。这项新研究提供了一种新的感染模型,该模型对于评估和批准用于人类SARS-CoV-2感染的预防和治疗策略以及评估重新利用物种特异性现有疗法(比如聚乙二醇化干扰素)的疗效至关重要。(生物谷 Bioon.com)
参考资料:
Barry Rockx et al. Comparative pathogenesis of COVID-19, MERS, and SARS in a nonhuman primate model. Science, 2020, doi:10.1126/science.abb7314.
两份关于三名COVID-19患者肺组织学检查的报告显示双侧弥漫性肺泡损伤(DAD)、肺水肿和透明膜形成,这表明存在急性呼吸窘迫综合征(ARDS)以及肺泡腔内特征性的多核巨细胞,这类似于2002/2003年SARS-CoV疫情爆发期间的调查结果。先前曾在非人类灵长类动物模型(食蟹猴)中研究过SARS-CoV感染的发病机理,在这种动物模型中,年老动物更容易患病。
在一项新的研究中,来自荷兰多家研究机构的研究人员在食蟹猴中描述了SARS-CoV-2感染的特征,并与MERS-CoV感染和SARS-CoV的历史数据进行了比较。相关研究结果于2020年4月17日在线发表在Science期刊上,论文标题为“Comparative pathogenesis of COVID-19, MERS, and SARS in a nonhuman primate model”。
首先,通过气管内(intratracheal, IT)和鼻内(intranasal, IN)联合途径给两组4只食蟹猴(一组年龄较为年轻,4~5岁;另一组年龄较大,15~20岁)接种了来自一名从中国返回的德国旅行者的SARS-CoV-2毒株。除了在接种后第14天在一只年老食蟹猴中出现了浆液性鼻液之外,在任何感染的食蟹猴中均未观察到明显的临床症状。在研究期间,在任何食蟹猴中均未观察到明显的体重减轻。到接种后第14天,鉴于血清中存在针对SARS-CoV-2病毒S1结构域和核衣壳蛋白的特异性抗体,所有剩余的食蟹猴都发生了血清转化。
作为衡量病毒脱落的一种手段,利用RT-qPCR和病毒培养法对鼻腔、咽喉和直肠拭子进行病毒检测。在鼻腔拭子中,对SARS-CoV-2 RNA的检测值在年轻食蟹猴的接种后第2天达到峰值,在年老食蟹猴的接种后第4天达到峰值;在4只食蟹猴中,有2只在接种后第8天仍可检测到SARS-CoV-2 RNA,有1只在接种后第21天仍可检测到SARS-CoV-2 RNA(图1A)。总体而言,与年轻食蟹猴相比,在年老食蟹猴的鼻腔拭子中检测到更高水平的SARS-CoV-2 RNA。

图1.在接种SARS-CoV-2的食蟹猴器官中的病毒脱落和病毒检测。图片来自Science, 2020, doi:10.1126/science.abb7314。
咽喉拭子中的SARS-CoV-2 RNA检测值在年轻食蟹猴接种后第1天达到高峰,而年老食蟹猴接种后第4天达到高峰,但相比于鼻腔拭子,随着时间的推移,咽喉拭子中的检测值下降得更快,不过直到接种后第10天仍可间歇性地检测到SARS-CoV-2 RNA(图1B)。分别从接种后第2天和第4天开始,利用咽喉和鼻腔拭子培养低水平的传染性病毒。为了确定这些食蟹猴脱落病毒,进行了环境采样以确定潜在的物体表面污染。环境采样表明通过隔离器内的直接接触(手)和间接污染,物体表面上存在低水平的SARS-CoV-2 RNA。在接种后第14天,仅在一只食蟹猴的直肠拭子中检测到SARS-CoV-2 RNA,此外在整个研究的任何时间点,全血中均未检测到病毒RNA。
在接种后第4天对4只食蟹猴进行尸检时,两只的肺部有肺实变病灶(图2A)。第一只食蟹猴(年龄:17岁)显示出右肺中叶(占肺部组织的5%不到)实变。第二只食蟹猴(年龄:5岁)在左肺下叶(约占肺部组织的10%)有两个病灶(图2A)。肺实变组织界限清楚,呈红紫色,浮力比正常时较小。这两只食蟹猴的其他器官以及呼吸道都正常。另外两只食蟹猴均正常。

图2.接种SARS-CoV-2的食蟹猴肺部的特征性病理变化和病毒抗原表达。图片来自Science, 2020, doi:10.1126/science.abb7314。
在接种后第4天通过RT-qPCR评估了来自呼吸道、消化道、泌尿道、心血管道、内分泌系统和中枢神经系统的组织以及各种淋巴组织中的病毒复制。病毒复制主要限于呼吸道(鼻腔、气管、支气管、支气管和肺叶),其中肺部SARS-CoV-2 RNA水平最高(图1C)。令人关注的是,在4只食蟹猴中,有3只的回肠和气管-支气管淋巴结中也检测到SARS-CoV-2 RNA(图1C)。
年轻和年老食蟹猴肺实变组织中的主要组织学病变涉及肺泡和细支气管,由急性或较晚期的DAD区域组成(图2B)。在这些区域中,肺泡和细支气管的管腔内不同程度地充满了富含蛋白的水肿液、纤维蛋白、细胞碎片和肺泡巨噬细胞,而中性粒细胞和淋巴细胞较少(图2C-E)。来自肺泡壁和细支气管壁的上皮大量脱落,并存在上皮坏死。在少数受损的肺泡中出现了透明膜。在病变较严重的区域,肺泡壁中度增厚并排列着立方体状的上皮细胞(II型肺细胞增生),肺泡腔空洞化。肺泡壁和支气管壁被水肿液、单核细胞和中性粒细胞增厚。肺小血管周围有淋巴细胞聚集。支气管壁的固有层和粘膜下层有适量的淋巴细胞和巨噬细胞,支气管上皮有少量中性粒细胞。上皮再生可在一些支气管中观察到:一层不规则的鳞状至高位立方体状的上皮细胞,细胞核深染。在支气管和肺泡的管腔内偶有游离的多核巨细胞(syncytia)(图2F),根据阳性的泛角蛋白染色和阴性的CD68染色,这些细胞似乎来源于上皮细胞(图2F)。
在DAD病灶内检测到中等数量的I型肺细胞和少量II型肺细胞表达SARS-CoV-2抗原(图2G,图2H)。针对它们的染色模式与受到SARS-CoV感染的食蟹猴肺部组织中的染色模式相似(阳性对照)。没有在多核巨细胞中观察到SARS-CoV-2抗原的表达。此外,在4只食蟹猴中的3只(包括2只年轻食蟹猴和1只年老食蟹猴)的所有肺叶的非病变组织中检测到SARS-CoV-2抗原表达,在少数I型和II型肺细胞、支气管纤毛上皮细胞和细支气管纤毛上皮细胞中也检测到SARS-CoV-2抗原的表达。另一只年老食蟹猴在肺部中没有SARS-CoV-2感染的病毒学或病理学证据,但是在鼻中隔、鼻甲和软腭的纤毛上皮细胞中确实有SARS-CoV-2抗原的表达,不过没有相关的组织病理变化(图2I)。在其他取样的组织(包括大脑和肠道)中,均未发现SARS-CoV抗原的表达。
为了评估与MERS-CoV相比,SARS-CoV-2感染的严重程度,这些研究人员通过气管内和鼻内联合途径给3~5岁的年轻食蟹猴接种MERS-CoV。所有食蟹猴均无临床症状。在接种后第21天,通过ELISA法检测血清中的MERS-CoV特异性抗体的存在,显示所有剩余的食蟹猴(n=2)都发生了血清转化。
分别在接种后第1~11天在鼻腔拭子(图3A)和咽喉拭子(图3B)中检测到了MERS-CoV RNA,在接种后第1天和第2天分别在鼻腔拭子和咽喉拭子检测到的MERS-CoV RNA达到峰值。在接种后的第2天和第3天,低水平(在1~85 TCID50当量/毫升之间)的MERS-CoV RNA在直肠拭子中检测到。

图3.接种MERS-CoV的食蟹猴器官的病毒脱落和病毒检测。图片来自Science, 2020, doi:10.1126/science.abb7314。
在接种后第4天对4只食蟹猴的尸检中,有3只存在肺实变病灶,其特征是肺部有轻微的凹陷区域,占肺部组织的5%不到(表1)。与年轻和年老食蟹猴中SARS-CoV-2感染的相类似,在接种后第4天,MERS-CoV RNA主要在接种的食蟹猴的呼吸道中检测到(图3C)。传染性MERS-CoV病毒滴度与SARS-CoV-2相似,但与年轻食蟹猴中的SARS-CoV感染相比较低(表1)。此外,在脾脏中检测到MERS-CoV RNA(表1)。

表1.比较食蟹猴中SARS-CoV-2、MERS-CoV和SARS-CoV感染的发病机制。图片来自Science, 2020, doi:10.1126/science.abb7314。
与在接种后第4天病毒在下呼吸道中的存在相一致的是,在接种的食蟹猴的肺部中观察到DAD特异性的组织病理学变化(图3D)。中性粒细胞和巨噬细胞的浸润使得肺泡隔增厚,中度II型肺细胞增生和肥大。在肺泡腔中,肺泡巨噬细胞升高,一些水肿液中含有纤维蛋白和一些中性粒细胞(图3D)。在肺泡腔中很少看到有多核巨细胞。值得注意的是,MERS-CoV抗原在接种后第4天并没有在呼吸道的任何部位检测到。因此,这些研究人员在接种后第1天的时候,对四只年轻食蟹猴进行了采样。在这时,他们观察到病毒抗原的多灶性表达主要见于II型肺细胞,偶尔见于I型肺细胞、细支气管上皮细胞和支气管上皮细胞以及一些巨噬细胞。
综上所述,这些研究人员给年轻和年老食蟹猴接种低传代的SARS-CoV-2临床分离株,在没有明显临床症状的情况下导致生产性感染。最近对人类病例的研究表明,症状前和无症状的病例也会出现病毒脱落。年龄的增加并不影响疾病的结果,但是年老动物的上呼吸道病毒脱落时间延长。在SARS-CoV-2和SARS-CoV患者中都观察到延长的病毒脱落。令人关注的是,在这项新研究的无症状动物模型中,SARS-CoV-2病毒脱落在感染过程的早期达到高峰,类似于无症状患者的情况。此外,SARS-CoV-2抗原在接种后第4天在鼻粘膜纤毛上皮细胞中检测到,但是这一点在这种动物模型的SARS-CoV或MERS-CoV感染中未观察到。
病毒的鼻粘膜嗜性与有效的呼吸道传播相吻合,这一点在甲型流感病毒中已见过。SARS-CoV-2病毒脱落在感染早期达到高峰与流感病毒脱落相似,这可能解释了为何针对SARS-CoV-2的病例检测和隔离可能不如控制SARS-CoV的有效。SARS-CoV-2主要在呼吸道组织中检测到,但在肠道等其他组织中也可检测到SARS-CoV-2 RNA,这与近期的报告相一致。最近也在接种SARS-CoV-2的恒河猴中报道了关于病毒脱落及其组织和细胞嗜性的类似结果。然而,与这新研究中的动物模型不同的是,恒河猴中的SARS-CoV-2感染确实会导致短暂的呼吸道疾病和体重下降。
在这项新的研究中,4只食蟹猴中的2只在接种后第4天出现了DAD病灶。SARS-CoV-2抗原表达和DAD的共定位为SARS-CoV-2感染引起病变提供了强有力的证据。DAD的组织学特征,包括肺泡和支气管上皮坏死、肺泡水肿、透明膜形成以及中性粒细胞、巨噬细胞和淋巴细胞聚集,与针对人类COVID-19病例的有限病理分析相吻合。特别是,肺部病变中出现多核巨细胞是呼吸道冠状病毒感染的特征。虽然MERS-CoV主要感染食蟹猴的II型肺细胞,但SARS-CoV和SARS-CoV-2也感染I型肺细胞。I型肺细胞受损可导致肺水肿和透明膜形成,这可能解释了为何透明膜形成是SARS和COVID-19的特征,但在MERS中这方面的报道不多。
这些数据表明食蟹猴对SARS-CoV-2感染较为敏感,存在长时间脱落病毒,并表现出类似COVID-19的疾病。在这种非人类灵长类动物模型中,SARS-CoV-2在整个呼吸道组织(包括鼻腔、支气管、细支气管和肺泡)的呼吸道上皮细胞中有效地复制。上呼吸道中的病毒复制与宿主之间的有效传播相吻合,而下呼吸道中的病毒复制与肺部疾病的产生相吻合。对这种模型中SARS-CoV、MERS-CoV和SARS-CoV-2感染的深入比较,可能会发现这些新兴病毒的发病机制中的关键途径。这项新研究提供了一种新的感染模型,该模型对于评估和批准用于人类SARS-CoV-2感染的预防和治疗策略以及评估重新利用物种特异性现有疗法(比如聚乙二醇化干扰素)的疗效至关重要。(生物谷 Bioon.com)
参考资料:
Barry Rockx et al. Comparative pathogenesis of COVID-19, MERS, and SARS in a nonhuman primate model. Science, 2020, doi:10.1126/science.abb7314.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


