2020年3月Science期刊不得不看的亮点研究
来源:本站原创 2020-03-31 23:37
2020年3月31日讯/生物谷BIOON/---2020年3月份即将结束了,3月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.Science:重大进展!经过改进的CRISPR-Cas9不受PAM的限制,可靶向整个基因组中的任何位点doi:10.1126/science.aba8853许多基础研究人员和临床研究人员正在测试
2020年3月31日讯/生物谷BIOON/---2020年3月份即将结束了,3月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Science:重大进展!经过改进的CRISPR-Cas9不受PAM的限制,可靶向整个基因组中的任何位点
doi:10.1126/science.aba8853
许多基础研究人员和临床研究人员正在测试利用一种简单有效的基因编辑方法来研究和校正导致从失明到癌症等各种疾病的致病突变的潜力,但是这种技术受到一定限制,即必须在基因编辑位点附近存在某个较短的DNA序列。
如今,来自美国麻省总医院(MGH)的研究人员对这个基因编辑系统进行了改进,使得它几乎不再受到这种限制,从而有可能潜在地靶向整个人类基因组中的任何位点。相关研究结果于2020年3月26日在线发表在Science期刊上,论文标题为“Unconstrained genome targeting with near-PAMless engineered CRISPR-Cas9 variants”。

CRISPR/Cas9基因组编辑技术是一种免疫防御策略,被细菌用来切割入侵病毒的DNA。为了使得这种CRISPR-Cas9系统发挥作用,一种称为Cas9的细菌防御蛋白会寻找一个较短的称为间隔序列邻近基序(protospacer adjacent motif, PAM)的区域,这个区域存在于病毒DNA中,但不存在于细菌DNA中。CRISPR-Cas9已被用于编辑人类基因组,这是因为这样的PAM序列在我们的DNA中也很常见;但是,人们不能靶向不位于PAM附近的基因。为了克服这一障碍,在麻省总医院基因医学中心生物化学家Benjamin P. Kleinstiver的领导下,这些研究人员通过基因改造设计出两种不需要特定PAM就可结合和切割DNA的Cas9蛋白变体,并将它们命名为SpG和SpRY。这两种蛋白变体可允许以常规CRISPR-Cas9酶无法达到的效率编辑DNA序列。
Kleinstiver说,“鉴于这些经过改造的蛋白可以更自由地靶向DNA序列,因此它们可以靶向以前无法进入的基因组区域。通过几乎完全放松Cas9对识别PAM的要求,如今许多基因组编辑应用是可以实现的。鉴于几乎整个基因组都是可靶向的,因此最令人兴奋的意义之一是从DNA编辑的角度来看,整个基因组都是‘药物可靶向的(druggable)’。”
2.Science:在COVID-19疫情早期和后期采取旅行限制是最有用的
doi:10.1126/science.abb4218
新型冠状病毒SARS-CoV-2(之前称为2019-nCoV)导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。在一项新的研究中,来自美国东北大学、哈佛大学、波士顿儿童医院、华盛顿大学、英国牛津大学、南安普敦大学、法国巴斯德研究所、索邦大学、中国北京师范大学和厄瓜多尔基多圣弗朗西斯科大学的研究人员对人类流动性和流行病学数据进行了分析,发现人类流动性可预测COVID-19疫情在中国的传播。不幸的是,对武汉的出行限制来得晚了些,而且研究显示随着COVID-19疫情蔓延,出行限制的影响在下降。湖北省以外的中国省份较早地采取行动来测试、追踪和遏制输入的COVID-19病例,在预防或遏制当地疫情方面发挥了最佳作用。相关研究结果于2020年3月25日在线发表在Science期刊上,论文标题为“The effect of human mobility and control measures on the COVID-19 epidemic in China”。
来自百度公司的移动地理位置数据,结合来自Open COVID-19数据工作组(Open COVID-19 Data Working Group)的丰富流行病学数据集,显示当地的人际传播在这种冠状病毒疫情爆发的早期就广泛发生,并且通过严格的控制措施得以缓解。但是,平均潜伏期为5天,在某些情况下长达14天,这些流动性限制在一周多的时间内并未开始对新病例的数据产生积极影响---在封锁后的5~7天内,情况似乎变得更糟,这是因为当地的传播正在进行中。
在湖北省以外地区报告的病例中,有515例已知到过武汉旅行,且症状发作日期是2020年1月31日之前,而1月31日之后只有39例到过武汉旅行,这说明旅行限制对减少向中国其他省份的传播具有影响。
论文共同通讯作者、牛津大学动物学系的Moritz Kraemer博士说,“我们的发现表明,在这种冠状病毒疫情暴发的早期采取旅行限制有效地阻止了从已知来源输入的感染。但是,一旦COVID-19病例开始在当地传播,新输入病例的贡献就小得多。这就需要采取包括地方流动限制、检测、跟踪和隔离在内的一整套措施来减轻疫情。成功阻止了COVID-19内部传播的中国各省和其他国家需要仔细考虑如何管理恢复旅行和流动,以避免这种疾病在人群中重新出现和传播。”
3.Science:研究表明阳性选择是造血的主要驱动力
doi:10.1126/science.aay9333
近日,剑桥大学,斯坦福大学和华盛顿大学医学院的一组研究人员发现了新的证据,表明阳性选择是塑造克隆性造血(clonal hematopoiesis)能力的主要驱动力。在《Science》杂志上发表的论文中,作者描述了他们对克隆性造血功能的研究以及他们从中学到的知识。
包括人类在内的有机体通过不断的细胞分裂而得以存活,这也是人体部位不断恢复活力的方式。但有时在分裂的过程中会产生突变,一些突变则是进化的驱动力,而其它一些突变可能对机体有害。先前的研究发现,随着时间的流逝,年龄的增长,可能会产生突变,这可能是有益的,也可能不是有益的。然而,科学家们至今仍未完全理解细胞分裂产生的突变的生物学意义。
先前的研究表明,克隆性造血是一种常见的与年龄相关的现象,其中血液中的造血干细胞或其他祖细胞参与形成与常规血细胞遗传上不同的血细胞群体。此外,某些突变可能是良性的,但已发现其他一些突变会引发癌前病变。这项新工作的研究人员试图了解有关此过程的更多信息。
这项工作涉及分析来自9个公共数据库的有关50,000多名癌症患者的血液肿瘤数据的信息。他们针对每个样本的变异等位基因频率(VAF)进行了编目分类。然后,他们使用数据建立了代表造血干细胞动力学的随机分支模型。除其他外,他们的模型显示中性突变要么很快灭绝,要么生长缓慢,并保持较低的VAF值。而且还表明,有益突变呈指数增长。综上所述,该模型表明,对有益突变的积极选择(而不是遗传漂移)决定了血液的遗传多样性。
4.Science:在活细胞、组织和动物中进行功能性材料的基因靶向化学组装
doi:10.1126/science.aay4866; doi:10.1126/science.abb0216
在一项新的研究中,来自美国斯坦福大学的研究人员利用他们开发出的一种技术对细胞进行重编程,使得它们使用他们提供的合成材料来构建能够在体内执行功能的人工结构。相关研究结果发表在2020年3月20日的Science期刊上,论文标题为“Genetically targeted chemical assembly of functional materials in living cells, tissues, and animals”。

这些研究人员解释了他们如何开发出一种称为基因靶向化学组装(genetically targeted chemical assembly, GTCA)的方法,并使用这种新方法在哺乳动物脑细胞和秀丽隐杆线虫的神经元上构建人工结构。这些结构是使用两种不同的生物相容性材料制成的,每种材料具有不同的电子特性。一种材料是绝缘体,另一种材料是导体。
论文共同通讯作者、斯坦福大学化学工程学教授Zhenan Bao说,尽管当前的实验主要集中在脑细胞或神经元上,但是GTCA也应当适用于其他的细胞类型。Bao说,“我们开发出一种技术平台,它可以利用整个身体中的细胞生化过程。”
5.Science:我国科学家从结构上揭示人胰高血糖素受体的G蛋白特异性识别机制
doi:10.1126/science.aaz5346
G蛋白偶联受体(GPCR)在细胞信号转导中起重要作用,并作为多种疾病的重要治疗靶标。与细胞外激动剂结合后,GPCR通过招募不同的G蛋白(Gs、Gi和Gq等)刺激各种信号通路以介导多种生理功能。GPCR和特定G蛋白之间的选择性偶联对于这类受体的生物学作用至关重要。但是,确定单个GPCR如何识别不同G蛋白亚型的分子细节仍然难以捉摸,因此限制了对GPCR信号转导机制的理解。
在一项新的研究中,来自中国科学院上海药物研究所、复旦大学和上海科技大学等研究机构的研究人员利用低温电镜(cryo-EM)技术解析出人胰高血糖素受体(GCGR)与它的同源激动剂和不同类型的G蛋白(Gs或Gi)结合在一起时的三维结构。相关研究结果发表在2020年3月20日的Science期刊上,论文标题为“Structural basis of Gs and Gi recognition by the human glucagon receptor”。
这些结构首次提供了GPCR与不同G蛋白亚型之间相互作用模式的详细分子图,并且出乎意料地揭示了许多调控G蛋白特异性的分子特征,从而极大地加深了对GPCR信号转导机制的理解。
6.Science:新研究表明人们迫切需要新方法来抵抗疫苗衍生脊髓灰质炎病毒
doi:10.1126/science.aba1238
在一项新的研究中,来自英国、瑞士、美国和刚果的研究人员发现人们迫切需要对抗疫苗衍生脊髓灰质炎病毒(vaccine-derived poliovirus)。相关研究结果于2020年3月19日在线发表在Science期刊上,论文标题为“Evolving epidemiology of poliovirus serotype 2 following withdrawal of the type 2 oral poliovirus vaccine”。在这篇论文中,他们描述了对疫苗衍生脊髓灰质炎病毒的研究以及他们取得的发现。
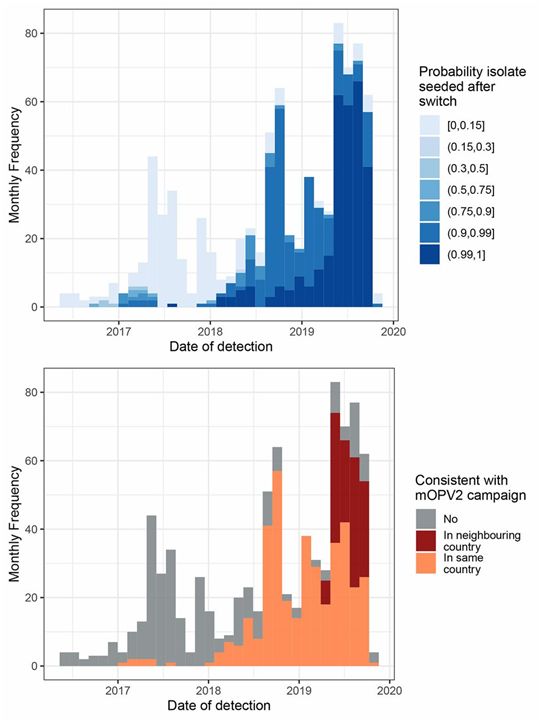
野生型脊髓灰质炎病毒有1、2和3型三种。大约2年前,2型脊髓灰质炎病毒在自然环境下被根除,但是这种接种的疫苗造成了一个挥之不去的问题---一种疫苗衍生的突变病毒像野生型脊髓灰质炎病毒那样扩散,也能使感染者瘫痪。这种称为OPV2的疫苗在被人们发现它的使用导致了一种突变病毒后不久就被停止使用,但是这种疫苗衍生的脊髓灰质炎病毒却存活了下来。阻止人们感染它的唯一方法是给他们接种OPV2疫苗---但是重新注射这种疫苗会导致更多突变病毒的产生。由于这个原因,这些研究人员指出,需要一种新的疫苗。他们的研究表明这种需求是多么迫切。
这项新的研究涉及运行统计模型,以显示如果不开发新疫苗并尽快投入使用,这种突变脊髓灰质炎病毒可能如何传播。他们发现这种突变病毒最早出现在2016年至2019年之间。从那以后,全球脊髓灰质炎实验室网络(Global Polio Laboratory Network)已在26个国家确认了859例突变脊髓灰质炎病毒感染病例。他们进一步发现大约65.5%的感染是在“切换(Switch)”---卫生工作者从给人们接种两种不同的疫苗来抵抗1型和3型脊髓灰质炎病毒切换到接种一种对这两种类型的髓灰质炎病毒都有效的疫苗---之后发生的。他们总共确定了62个切换后(post-Switch)事件和41次突变脊髓灰质炎病毒流行病爆发。卫生官员通过重新引入OPV2疫苗来对抗这些流行病爆发,从而导致了更多的突变脊髓灰质炎病毒流行病爆发。
7.Science:液-液相分离促进皮肤屏障形成
doi:10.1126/science.aax9554; doi:10.1126/science.abb0060
在一项新的研究中,来自美国洛克菲勒大学的研究人员发现皮肤中蛋白的相分离问题可能导致某些皮肤疾病的产生。相关研究结果近期发表在Science期刊上,论文标题为“Liquid-liquid phase separation drives skin barrier formation”。在这篇论文中,他们描述了他们对小鼠组织中液-液相分离(liquid-liquid phase separation)的研究以及他们发现的结果。瑞士苏黎世大学的Arpan Rai和Lucas Pelkmans针对这项研究在同期Science期刊上发表了一篇标题为“Liquid droplets in the skin”的观点类型文章。
先前的研究已表明作为皮肤的最外层,表皮(epidermis)由角质形成细胞(即产生角蛋白的细胞)组成。表皮是由这样的细胞层组成的,这些细胞不断地向上迁移到表皮中。当它们这样做时,它们经历了一个转变,失去了它们的细胞器,并在这个过程中变成了鳞片(squams),最终完全死亡,被丢弃到环境中。皮肤表面上的鳞片层在环境和身体内部组织之间形成保护性屏障。在这项新的研究中,这些研究人员试图更多地了解表皮中细胞进行转化的过程,以更好地了解包括癌症在内的皮肤疾病。
为了了解有关该过程的更多信息,这些研究人员研究了小鼠组织。更具体地说,他们研究了丝聚合蛋白原(profilaggrin),即一种通常位于颗粒层(stratum granulosum)中的蛋白丝。颗粒层是刚好位于角质层(皮肤表面层)下方的一个皮肤层。他们发现,在丝聚合蛋白原的液-液相分离过程中产生的透明角质颗粒(keratohyalin granule)与角蛋白丝相互作用,而角蛋白丝是分化过程中角质形成细胞组织化过程的一部分。相分离是由于分化特异性蛋白在角质形成细胞中的积累,这使得这些细胞经历了一种类似于油醋分离的相变。这导致越来越粘稠的蛋白液滴挤满细胞质。结果是透明角质颗粒溶解,从而导致丝聚合蛋白原分解为单体。这些单体然后与其他蛋白相互作用,从而导致细胞内蛋白基质的形成。
8.Science:反常!一种淀粉样蛋白非但不致病,而且还有助于储存记忆
doi:10.1126/science.aba3526
人们已知一种称为胞质聚腺苷酸化元件结合蛋白(CPEB)的mRNA结合蛋白与长期记忆存储相关联。Orb2是CPEB蛋白的果蝇版本。在一项新的研究中,来自美国斯托瓦斯医学研究所、华盛顿大学和堪萨斯大学医学中心的研究人员首次描述了一种内源性的功能性神经元淀粉样蛋白在原子分辨率下的结构。这种淀粉样蛋白由Orb2蛋白自聚集而成。这些研究结果可能产生一些非常有趣的影响。相关研究结果近期发表在Science期刊上,论文标题为“Cryo-EM structure of a neuronal functional amyloid implicated in memory persistence in Drosophila”。
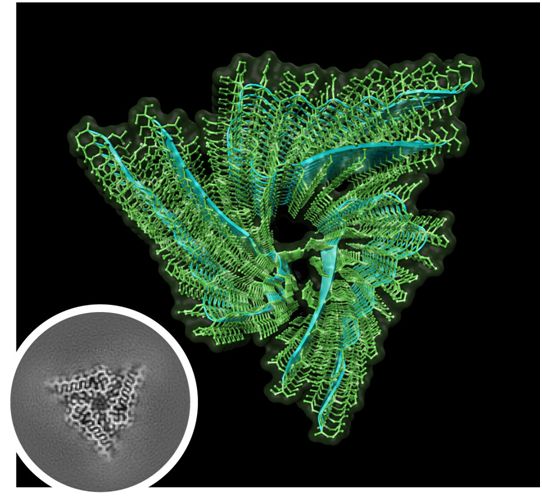
论文通讯作者、斯托瓦斯医学研究所研究员Kausik Si博士说,“我们认为当一种蛋白由于某种原因变坏或错误折叠时,淀粉样蛋白通常就会产生,这提示着淀粉样蛋白在一种随机的、不受控制的过程中形成。相反,我们发现淀粉样蛋白可以在特定时间和特定细胞中以特定方式形成。”
9.中美科学家Science:无症状患者的传播是导致SARS-CoV-2扩散的主要原因
doi:10.1126/science.abb3221
研究人员在3月16日出版的《Science》杂志上总结称,在中国实施旅行限制之前的1月份,约86%的COVID-19病例病情较轻,但在持续两周的疫情加剧期间未被发现。
高级研究员Jeffrey Shaman说,这些未被记录在案的感染病例"每个人的传染性大约只有有记录病例的一半,而后者的症状更严重,而且可能还有很多未被发现。"他是哥伦比亚大学梅尔曼公共卫生学院的环境健康科学教授。
然而,Shaman说:"因为有更多的这些没有文件证明的病例,正是这些没有文件证明的感染推动了疫情的蔓延和扩大。"
因此,研究人员说,继续和扩大对各国封锁是正确的行动,以尽可能地限制COVID-19的流行。
10.Science重磅:发现15个引发头颈部鳞状细胞癌快速生长的基因
doi:10.1126/science.aax0902
加拿大几个研究机构的一个研究小组发现了15个肿瘤抑制基因,当它们发生突变时,可以引发人类头颈部鳞状细胞癌(HNSCC)的快速生长。在他们发表在《Science》杂志上的论文中,该小组描述了他们的反向遗传CRISPR筛选技术,这使他们能够分析近500个导致HNSCC的长尾基因突变。
HNSCC是第六常见的人类癌症,不幸的是,其存活率很低。正如研究人员所说,迄今为止,大多数寻求治愈的研究都集中在少数几个突变率非常高的基因上,这让它们备受瞩目。但还有另一类突变较慢的基因,可能导致肿瘤患者人数较少。先前的研究表明,有数百种所谓的"长尾"基因,其中许多尚未被识别。在这项新的研究中,研究人员使用了一个反向基因CRISPR筛查技术,使他们能够识别其中的15个基因。
这项工作的重点是调节细胞分裂的肿瘤抑制基因。当它们出了问题,比如发生了突变,它们就失去了功能,因此无法阻止它们所调节的细胞发生失控的突变。更具体地说,研究小组将他们的注意力集中在细胞中notch信号通路的一部分基因上--特别是那些发展成HNSCC肿瘤的细胞。所有哺乳动物都有四种notch受体,用于细胞间的交流。该团队在体内对484个引起小鼠肿瘤发生的长尾基因突变进行了CRISPR筛选,鉴定出了15个肿瘤抑制基因。然后,他们在人类长尾突变中寻找相同类型的突变,并计算每种突变的百分比。(生物谷 Bioon.com)
1.Science:重大进展!经过改进的CRISPR-Cas9不受PAM的限制,可靶向整个基因组中的任何位点
doi:10.1126/science.aba8853
许多基础研究人员和临床研究人员正在测试利用一种简单有效的基因编辑方法来研究和校正导致从失明到癌症等各种疾病的致病突变的潜力,但是这种技术受到一定限制,即必须在基因编辑位点附近存在某个较短的DNA序列。
如今,来自美国麻省总医院(MGH)的研究人员对这个基因编辑系统进行了改进,使得它几乎不再受到这种限制,从而有可能潜在地靶向整个人类基因组中的任何位点。相关研究结果于2020年3月26日在线发表在Science期刊上,论文标题为“Unconstrained genome targeting with near-PAMless engineered CRISPR-Cas9 variants”。

图片来自CC0 Public Domain。
CRISPR/Cas9基因组编辑技术是一种免疫防御策略,被细菌用来切割入侵病毒的DNA。为了使得这种CRISPR-Cas9系统发挥作用,一种称为Cas9的细菌防御蛋白会寻找一个较短的称为间隔序列邻近基序(protospacer adjacent motif, PAM)的区域,这个区域存在于病毒DNA中,但不存在于细菌DNA中。CRISPR-Cas9已被用于编辑人类基因组,这是因为这样的PAM序列在我们的DNA中也很常见;但是,人们不能靶向不位于PAM附近的基因。为了克服这一障碍,在麻省总医院基因医学中心生物化学家Benjamin P. Kleinstiver的领导下,这些研究人员通过基因改造设计出两种不需要特定PAM就可结合和切割DNA的Cas9蛋白变体,并将它们命名为SpG和SpRY。这两种蛋白变体可允许以常规CRISPR-Cas9酶无法达到的效率编辑DNA序列。
Kleinstiver说,“鉴于这些经过改造的蛋白可以更自由地靶向DNA序列,因此它们可以靶向以前无法进入的基因组区域。通过几乎完全放松Cas9对识别PAM的要求,如今许多基因组编辑应用是可以实现的。鉴于几乎整个基因组都是可靶向的,因此最令人兴奋的意义之一是从DNA编辑的角度来看,整个基因组都是‘药物可靶向的(druggable)’。”
2.Science:在COVID-19疫情早期和后期采取旅行限制是最有用的
doi:10.1126/science.abb4218
新型冠状病毒SARS-CoV-2(之前称为2019-nCoV)导致2019年冠状病毒病(COVID-19),如今正在全球肆虐。在一项新的研究中,来自美国东北大学、哈佛大学、波士顿儿童医院、华盛顿大学、英国牛津大学、南安普敦大学、法国巴斯德研究所、索邦大学、中国北京师范大学和厄瓜多尔基多圣弗朗西斯科大学的研究人员对人类流动性和流行病学数据进行了分析,发现人类流动性可预测COVID-19疫情在中国的传播。不幸的是,对武汉的出行限制来得晚了些,而且研究显示随着COVID-19疫情蔓延,出行限制的影响在下降。湖北省以外的中国省份较早地采取行动来测试、追踪和遏制输入的COVID-19病例,在预防或遏制当地疫情方面发挥了最佳作用。相关研究结果于2020年3月25日在线发表在Science期刊上,论文标题为“The effect of human mobility and control measures on the COVID-19 epidemic in China”。
来自百度公司的移动地理位置数据,结合来自Open COVID-19数据工作组(Open COVID-19 Data Working Group)的丰富流行病学数据集,显示当地的人际传播在这种冠状病毒疫情爆发的早期就广泛发生,并且通过严格的控制措施得以缓解。但是,平均潜伏期为5天,在某些情况下长达14天,这些流动性限制在一周多的时间内并未开始对新病例的数据产生积极影响---在封锁后的5~7天内,情况似乎变得更糟,这是因为当地的传播正在进行中。
在湖北省以外地区报告的病例中,有515例已知到过武汉旅行,且症状发作日期是2020年1月31日之前,而1月31日之后只有39例到过武汉旅行,这说明旅行限制对减少向中国其他省份的传播具有影响。
论文共同通讯作者、牛津大学动物学系的Moritz Kraemer博士说,“我们的发现表明,在这种冠状病毒疫情暴发的早期采取旅行限制有效地阻止了从已知来源输入的感染。但是,一旦COVID-19病例开始在当地传播,新输入病例的贡献就小得多。这就需要采取包括地方流动限制、检测、跟踪和隔离在内的一整套措施来减轻疫情。成功阻止了COVID-19内部传播的中国各省和其他国家需要仔细考虑如何管理恢复旅行和流动,以避免这种疾病在人群中重新出现和传播。”
3.Science:研究表明阳性选择是造血的主要驱动力
doi:10.1126/science.aay9333
近日,剑桥大学,斯坦福大学和华盛顿大学医学院的一组研究人员发现了新的证据,表明阳性选择是塑造克隆性造血(clonal hematopoiesis)能力的主要驱动力。在《Science》杂志上发表的论文中,作者描述了他们对克隆性造血功能的研究以及他们从中学到的知识。
包括人类在内的有机体通过不断的细胞分裂而得以存活,这也是人体部位不断恢复活力的方式。但有时在分裂的过程中会产生突变,一些突变则是进化的驱动力,而其它一些突变可能对机体有害。先前的研究发现,随着时间的流逝,年龄的增长,可能会产生突变,这可能是有益的,也可能不是有益的。然而,科学家们至今仍未完全理解细胞分裂产生的突变的生物学意义。
先前的研究表明,克隆性造血是一种常见的与年龄相关的现象,其中血液中的造血干细胞或其他祖细胞参与形成与常规血细胞遗传上不同的血细胞群体。此外,某些突变可能是良性的,但已发现其他一些突变会引发癌前病变。这项新工作的研究人员试图了解有关此过程的更多信息。
这项工作涉及分析来自9个公共数据库的有关50,000多名癌症患者的血液肿瘤数据的信息。他们针对每个样本的变异等位基因频率(VAF)进行了编目分类。然后,他们使用数据建立了代表造血干细胞动力学的随机分支模型。除其他外,他们的模型显示中性突变要么很快灭绝,要么生长缓慢,并保持较低的VAF值。而且还表明,有益突变呈指数增长。综上所述,该模型表明,对有益突变的积极选择(而不是遗传漂移)决定了血液的遗传多样性。
4.Science:在活细胞、组织和动物中进行功能性材料的基因靶向化学组装
doi:10.1126/science.aay4866; doi:10.1126/science.abb0216
在一项新的研究中,来自美国斯坦福大学的研究人员利用他们开发出的一种技术对细胞进行重编程,使得它们使用他们提供的合成材料来构建能够在体内执行功能的人工结构。相关研究结果发表在2020年3月20日的Science期刊上,论文标题为“Genetically targeted chemical assembly of functional materials in living cells, tissues, and animals”。

这些研究人员解释了他们如何开发出一种称为基因靶向化学组装(genetically targeted chemical assembly, GTCA)的方法,并使用这种新方法在哺乳动物脑细胞和秀丽隐杆线虫的神经元上构建人工结构。这些结构是使用两种不同的生物相容性材料制成的,每种材料具有不同的电子特性。一种材料是绝缘体,另一种材料是导体。
论文共同通讯作者、斯坦福大学化学工程学教授Zhenan Bao说,尽管当前的实验主要集中在脑细胞或神经元上,但是GTCA也应当适用于其他的细胞类型。Bao说,“我们开发出一种技术平台,它可以利用整个身体中的细胞生化过程。”
5.Science:我国科学家从结构上揭示人胰高血糖素受体的G蛋白特异性识别机制
doi:10.1126/science.aaz5346
G蛋白偶联受体(GPCR)在细胞信号转导中起重要作用,并作为多种疾病的重要治疗靶标。与细胞外激动剂结合后,GPCR通过招募不同的G蛋白(Gs、Gi和Gq等)刺激各种信号通路以介导多种生理功能。GPCR和特定G蛋白之间的选择性偶联对于这类受体的生物学作用至关重要。但是,确定单个GPCR如何识别不同G蛋白亚型的分子细节仍然难以捉摸,因此限制了对GPCR信号转导机制的理解。
在一项新的研究中,来自中国科学院上海药物研究所、复旦大学和上海科技大学等研究机构的研究人员利用低温电镜(cryo-EM)技术解析出人胰高血糖素受体(GCGR)与它的同源激动剂和不同类型的G蛋白(Gs或Gi)结合在一起时的三维结构。相关研究结果发表在2020年3月20日的Science期刊上,论文标题为“Structural basis of Gs and Gi recognition by the human glucagon receptor”。
这些结构首次提供了GPCR与不同G蛋白亚型之间相互作用模式的详细分子图,并且出乎意料地揭示了许多调控G蛋白特异性的分子特征,从而极大地加深了对GPCR信号转导机制的理解。
6.Science:新研究表明人们迫切需要新方法来抵抗疫苗衍生脊髓灰质炎病毒
doi:10.1126/science.aba1238
在一项新的研究中,来自英国、瑞士、美国和刚果的研究人员发现人们迫切需要对抗疫苗衍生脊髓灰质炎病毒(vaccine-derived poliovirus)。相关研究结果于2020年3月19日在线发表在Science期刊上,论文标题为“Evolving epidemiology of poliovirus serotype 2 following withdrawal of the type 2 oral poliovirus vaccine”。在这篇论文中,他们描述了对疫苗衍生脊髓灰质炎病毒的研究以及他们取得的发现。

图片来自Science, 2020, doi:10.1126/science.aba1238。
野生型脊髓灰质炎病毒有1、2和3型三种。大约2年前,2型脊髓灰质炎病毒在自然环境下被根除,但是这种接种的疫苗造成了一个挥之不去的问题---一种疫苗衍生的突变病毒像野生型脊髓灰质炎病毒那样扩散,也能使感染者瘫痪。这种称为OPV2的疫苗在被人们发现它的使用导致了一种突变病毒后不久就被停止使用,但是这种疫苗衍生的脊髓灰质炎病毒却存活了下来。阻止人们感染它的唯一方法是给他们接种OPV2疫苗---但是重新注射这种疫苗会导致更多突变病毒的产生。由于这个原因,这些研究人员指出,需要一种新的疫苗。他们的研究表明这种需求是多么迫切。
这项新的研究涉及运行统计模型,以显示如果不开发新疫苗并尽快投入使用,这种突变脊髓灰质炎病毒可能如何传播。他们发现这种突变病毒最早出现在2016年至2019年之间。从那以后,全球脊髓灰质炎实验室网络(Global Polio Laboratory Network)已在26个国家确认了859例突变脊髓灰质炎病毒感染病例。他们进一步发现大约65.5%的感染是在“切换(Switch)”---卫生工作者从给人们接种两种不同的疫苗来抵抗1型和3型脊髓灰质炎病毒切换到接种一种对这两种类型的髓灰质炎病毒都有效的疫苗---之后发生的。他们总共确定了62个切换后(post-Switch)事件和41次突变脊髓灰质炎病毒流行病爆发。卫生官员通过重新引入OPV2疫苗来对抗这些流行病爆发,从而导致了更多的突变脊髓灰质炎病毒流行病爆发。
7.Science:液-液相分离促进皮肤屏障形成
doi:10.1126/science.aax9554; doi:10.1126/science.abb0060
在一项新的研究中,来自美国洛克菲勒大学的研究人员发现皮肤中蛋白的相分离问题可能导致某些皮肤疾病的产生。相关研究结果近期发表在Science期刊上,论文标题为“Liquid-liquid phase separation drives skin barrier formation”。在这篇论文中,他们描述了他们对小鼠组织中液-液相分离(liquid-liquid phase separation)的研究以及他们发现的结果。瑞士苏黎世大学的Arpan Rai和Lucas Pelkmans针对这项研究在同期Science期刊上发表了一篇标题为“Liquid droplets in the skin”的观点类型文章。
先前的研究已表明作为皮肤的最外层,表皮(epidermis)由角质形成细胞(即产生角蛋白的细胞)组成。表皮是由这样的细胞层组成的,这些细胞不断地向上迁移到表皮中。当它们这样做时,它们经历了一个转变,失去了它们的细胞器,并在这个过程中变成了鳞片(squams),最终完全死亡,被丢弃到环境中。皮肤表面上的鳞片层在环境和身体内部组织之间形成保护性屏障。在这项新的研究中,这些研究人员试图更多地了解表皮中细胞进行转化的过程,以更好地了解包括癌症在内的皮肤疾病。
为了了解有关该过程的更多信息,这些研究人员研究了小鼠组织。更具体地说,他们研究了丝聚合蛋白原(profilaggrin),即一种通常位于颗粒层(stratum granulosum)中的蛋白丝。颗粒层是刚好位于角质层(皮肤表面层)下方的一个皮肤层。他们发现,在丝聚合蛋白原的液-液相分离过程中产生的透明角质颗粒(keratohyalin granule)与角蛋白丝相互作用,而角蛋白丝是分化过程中角质形成细胞组织化过程的一部分。相分离是由于分化特异性蛋白在角质形成细胞中的积累,这使得这些细胞经历了一种类似于油醋分离的相变。这导致越来越粘稠的蛋白液滴挤满细胞质。结果是透明角质颗粒溶解,从而导致丝聚合蛋白原分解为单体。这些单体然后与其他蛋白相互作用,从而导致细胞内蛋白基质的形成。
8.Science:反常!一种淀粉样蛋白非但不致病,而且还有助于储存记忆
doi:10.1126/science.aba3526
人们已知一种称为胞质聚腺苷酸化元件结合蛋白(CPEB)的mRNA结合蛋白与长期记忆存储相关联。Orb2是CPEB蛋白的果蝇版本。在一项新的研究中,来自美国斯托瓦斯医学研究所、华盛顿大学和堪萨斯大学医学中心的研究人员首次描述了一种内源性的功能性神经元淀粉样蛋白在原子分辨率下的结构。这种淀粉样蛋白由Orb2蛋白自聚集而成。这些研究结果可能产生一些非常有趣的影响。相关研究结果近期发表在Science期刊上,论文标题为“Cryo-EM structure of a neuronal functional amyloid implicated in memory persistence in Drosophila”。

图片来自Si Lab, Stowers Institute for Medical Research。
论文通讯作者、斯托瓦斯医学研究所研究员Kausik Si博士说,“我们认为当一种蛋白由于某种原因变坏或错误折叠时,淀粉样蛋白通常就会产生,这提示着淀粉样蛋白在一种随机的、不受控制的过程中形成。相反,我们发现淀粉样蛋白可以在特定时间和特定细胞中以特定方式形成。”
9.中美科学家Science:无症状患者的传播是导致SARS-CoV-2扩散的主要原因
doi:10.1126/science.abb3221
研究人员在3月16日出版的《Science》杂志上总结称,在中国实施旅行限制之前的1月份,约86%的COVID-19病例病情较轻,但在持续两周的疫情加剧期间未被发现。
高级研究员Jeffrey Shaman说,这些未被记录在案的感染病例"每个人的传染性大约只有有记录病例的一半,而后者的症状更严重,而且可能还有很多未被发现。"他是哥伦比亚大学梅尔曼公共卫生学院的环境健康科学教授。
然而,Shaman说:"因为有更多的这些没有文件证明的病例,正是这些没有文件证明的感染推动了疫情的蔓延和扩大。"
因此,研究人员说,继续和扩大对各国封锁是正确的行动,以尽可能地限制COVID-19的流行。
10.Science重磅:发现15个引发头颈部鳞状细胞癌快速生长的基因
doi:10.1126/science.aax0902
加拿大几个研究机构的一个研究小组发现了15个肿瘤抑制基因,当它们发生突变时,可以引发人类头颈部鳞状细胞癌(HNSCC)的快速生长。在他们发表在《Science》杂志上的论文中,该小组描述了他们的反向遗传CRISPR筛选技术,这使他们能够分析近500个导致HNSCC的长尾基因突变。
HNSCC是第六常见的人类癌症,不幸的是,其存活率很低。正如研究人员所说,迄今为止,大多数寻求治愈的研究都集中在少数几个突变率非常高的基因上,这让它们备受瞩目。但还有另一类突变较慢的基因,可能导致肿瘤患者人数较少。先前的研究表明,有数百种所谓的"长尾"基因,其中许多尚未被识别。在这项新的研究中,研究人员使用了一个反向基因CRISPR筛查技术,使他们能够识别其中的15个基因。
这项工作的重点是调节细胞分裂的肿瘤抑制基因。当它们出了问题,比如发生了突变,它们就失去了功能,因此无法阻止它们所调节的细胞发生失控的突变。更具体地说,研究小组将他们的注意力集中在细胞中notch信号通路的一部分基因上--特别是那些发展成HNSCC肿瘤的细胞。所有哺乳动物都有四种notch受体,用于细胞间的交流。该团队在体内对484个引起小鼠肿瘤发生的长尾基因突变进行了CRISPR筛选,鉴定出了15个肿瘤抑制基因。然后,他们在人类长尾突变中寻找相同类型的突变,并计算每种突变的百分比。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


