遗传性血管水肿(HAE)新药!欧盟CHMP推荐批准Ruconest,用于治疗≥2岁儿童!
来源:本站原创 2020-03-30 15:40
2020年3月30日讯 /生物谷BIOON/ --Pharming Group近日宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布一份积极审查意见,建议批准Ruconest(conestat alfa),用于年龄≥2岁的遗传性血管水肿(HAE)儿童患者,治疗急性血管水肿发作。现在,CHMP的意见将递交至欧盟委员会(EC)审查,后者通常会在2
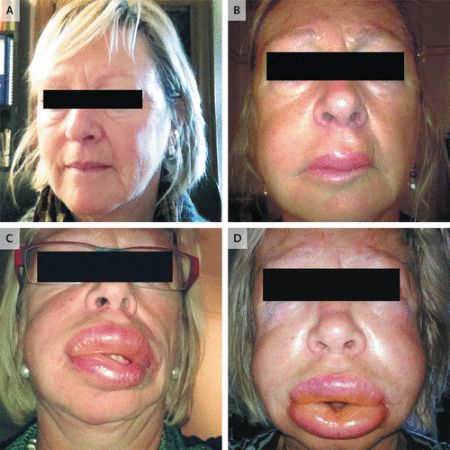
血管水肿(图片来源:新英格兰医学杂志,NEJM)
2020年3月30日讯 /生物谷BIOON/ --Pharming Group近日宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布一份积极审查意见,建议批准Ruconest(conestat alfa),用于年龄≥2岁的遗传性血管水肿(HAE)儿童患者,治疗急性血管水肿发作。现在,CHMP的意见将递交至欧盟委员会(EC)审查,后者通常会在2个月内做出最终审查决定。
Ruconest是一种重组人C1酯酶抑制剂的类似物,通过重组DNA技术从转基因兔子的奶液中纯化生产。在欧盟,该药于2010年被批准用于治疗HAE成人患者、2016年被批准用于治疗HAE青少年患者。如果获得EC批准,Ruconest在欧盟的适用年龄范围将进一步扩大至≥2岁的HAE儿童患者。
遗传性血管水肿(HAE)是一种罕见的疾病,由C1酯酶抑制剂蛋白缺乏引起,其特征是身体不同部位的皮肤、呼吸道和内脏自发和反复出现肿胀(水肿发作)。喉咙、鼻子或舌头的水肿特别危险,可能危及生命,并可能导致气道阻塞。Ruconest旨在恢复患者血浆中功能性C1酯酶抑制剂的水平,从而治疗这种肿胀的急性发作,帮助减轻患者的症状。
CHMP的积极审查意见,基于一项儿科调查计划(RIP),该计划包括一项在HAE儿童患者中开展的II期研究。这是一项开放标签、单臂研究,共入组了20例HAE儿童患者,评估了Ruconest在50U/kg剂量下对2-13岁HAE患儿的药代动力学、安全性和疗效。研究中,20例HAE儿童以50U/kg剂量(最大4200U)治疗了73次HAE发作,并在父母协助的情况下完成了视觉模拟量表(VAS)评估。
结果显示,接受Ruconest治疗后,患者症状取得临床意义的缓解:给药至开始缓解的中位时间为60分钟(95%CI:60-653)、给药至最小症状的中位时间为123分钟(95%CI:120-126)。仅有3/73(4%)的患者接受了第二剂Ruconest治疗。研究中,Ruconest的安全性和耐受性良好。没有患者因不良事件退出研究,未发现相关的严重不良事件、过敏反应或中和抗体。(生物谷Bioon.com)
原文出处:CHMP Adopts Positive Opinion for Treatment of Acute Angioedema Attacks in Children With Hereditary Angioedema With RUCONEST
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


