两篇Cell子刊揭示寨卡病毒入侵大脑干细胞机制,利用这种机制有望治疗致命性的脑癌
来源:本站原创 2020-01-26 06:37
2020年1月26日讯/生物谷BIOON/---让寨卡病毒最广为人知的时间可能是在2015年至2016年,当时一次大规模的寨卡病毒流行病主要影响拉丁美洲,但也影响了世界其他几个地区。尽管这一流行病已经过去,但寨卡病毒仍未消失。较小的局部爆发仍在继续,并且在去年夏天,欧洲记录了几例本地的寨卡病毒感染病例。科学家们警告,随着气候变化影响携带寨卡病毒的蚊子的栖息地
2020年1月26日讯/生物谷BIOON/---让寨卡病毒最广为人知的时间可能是在2015年至2016年,当时一次大规模的寨卡病毒流行病主要影响拉丁美洲,但也影响了世界其他几个地区。尽管这一流行病已经过去,但寨卡病毒仍未消失。较小的局部爆发仍在继续,并且在去年夏天,欧洲记录了几例本地的寨卡病毒感染病例。科学家们警告,随着气候变化影响携带寨卡病毒的蚊子的栖息地范围,这种病毒可能会继续传播。寨卡病毒还可以从怀孕的母亲传播给胎儿,也可通过性接触传播。地球上有超过一半的人有感染寨卡病毒的危险,而且目前还没有安全有效的药物或疫苗。
寨卡病毒感染会阻碍新生儿的大脑发育,从而导致一种称为小头畸形的疾病。在这种疾病中,婴儿出生时头部异常小。为了确定如何最好地阻止和治疗这种病毒感染,科学家们首先需要了解这种病原体如何进入脑细胞。
在两项新的研究中,来自美国加州大学圣地亚哥分校医学院的两个研究团队独立地鉴定出相同的分子---αvβ5整合素---是寨卡病毒入侵大脑干细胞的关键。他们还发现了利用这种整合素来阻止寨卡病毒感染细胞并让它发挥有益作用的方法:减少脑癌干细胞。
整合素是嵌入细胞表面的分子。它们在细胞粘附和通信中起重要作用,并且已知参与癌症的进展和转移。几种其他的整合素是诸如腺病毒、口蹄疫病毒和轮状病毒之类的其他病毒的已知入侵点,但αvβ5先前在病毒感染中的作用尚不为人所知。
寻找关键分子
在第一项新的研究中,加州大学圣地亚哥分校医学院的Tariq Rana博士及其研究团队使用CRISPR基因编辑系统性地剔除了在实验室培养皿中进行三维培养的人胶质母细胞瘤干细胞(glioblastoma stem cell, GSC,一种脑癌干细胞)中的每个基因。随后,他们让每种GSC细胞突变体暴露于寨卡病毒,以便确定哪些基因及其编码的蛋白是这种病毒入侵GSC细胞所必需的。这种病毒首次用绿色荧光蛋白(GFP)加以标记,从而允许这些研究人员可视化观察这种病毒入侵这些细胞。相关研究结果于2020年1月16日在线发表在Cell Reports期刊上,论文标题为“Integrin αvβ5 Internalizes Zika Virus during Neural Stem Cells Infection and Provides a Promising Target for Antiviral Therapy”。
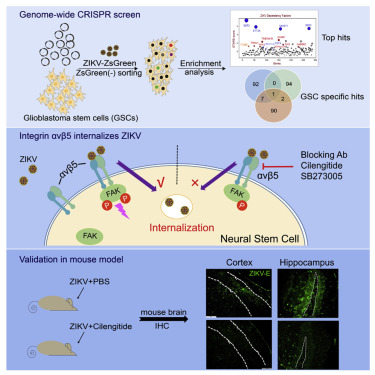
Rana团队发现了92个特异性的人脑癌干细胞基因是寨卡病毒入侵这种细胞并在其中复制所需要的。但是,其中的一个基因尤其重要,它就是编码αvβ5整合素的基因。
Rana说,“众所周知,整合素是许多不同的病毒用来入侵人细胞的分子。我原本期待发现寨卡病毒使用多种整合素,或者使用也被其他病毒使用的其他细胞表面分子。但是,我们发现寨卡病毒使用了αvβ5,这是比较独特的。当我们进一步研究αvβ5在大脑中的表达时,这完全可以理解,这是因为αvβ5是唯一在神经干细胞中富集的整合素成员,而寨卡病毒偏好感染神经干细胞。因此,我们认为αvβ5是寨卡病毒能够感染脑细胞的关键因素。”
阻断寨卡病毒感染
在第二项新的研究中,鉴于了解很多病毒使用整合素入侵人细胞,加州大学圣地亚哥分校医学院的Jeremy Rich博士及其研究团队使用不同的抗体来抑制每种整合素,以便观察哪种抗体具有最好的抑制效果。相关研究结果于2020年1月16日在线发表在Cell Stem Cell期刊上,论文标题为“Zika Virus Targets Glioblastoma Stem Cells through a SOX2-Integrin αvβ5 Axis”。
Rich说,“当我们阻断其他整合素时,效果上并没有区别。但是用抗体阻断αvβ5几乎可以完全阻断这种病毒感染脑癌干细胞和正常大脑干细胞的能力。”
Rich团队随后在胶质母细胞瘤小鼠模型中利用抗体抑制αvβ5,或者让编码它的基因失活。这两种方法都可阻止寨卡病毒感染,并且允许这些经过治疗的小鼠比未治疗的小鼠活得更长。他们还发现阻断在外科手术期间从患者身上取出的胶质母细胞瘤肿瘤样本中的αvβ5可阻断寨卡病毒感染。
此外,Rich团队每天用靶向αvβ5整合素的实验性抗癌药物西仑吉肽(cilengitide)或SB273005治疗小鼠,从而阻断它们体内的αvβ5。在寨卡病毒感染六天后,这些经过治疗的小鼠的大脑中的寨卡病毒数量是空白对照小鼠(mock-treated mice)中的一半。
Rana说,“有趣的是,这些发现不仅有助于推进寨卡病毒研究,而且还为我们利用抗体或小分子抑制剂类似地阻断使用其他整合素的多种病毒入侵提供了可能性。”
Rich团队如今正在培育一种大脑中缺乏αvβ5整合素的小鼠模型,这种模型将允许他们确定性地证实这种分子是寨卡病毒入侵和复制所必需的。
利用寨卡病毒治疗脑癌
Rich是一名神经肿瘤学家,擅长诊断和治疗胶质母细胞瘤患者,其中胶质母细胞瘤是一种极具侵袭性的致命性脑瘤。当他首次观察到寨卡病毒如何导致大脑组织萎缩时,他就想到了自己在治疗胶质母细胞瘤患者时所希望达到的效果。在2017年,他和合作者在一项研究中确定了寨卡病毒选择性地靶向并杀死胶质母细胞瘤干细胞(Journal of Experimental Medicine, 2017, doi:10.1084/jem.20171093)。鉴于这种脑癌干细胞容易对标准治疗产生抵抗力,这也是胶质母细胞瘤术后复发并导致患者存活率更低的重要原因。
Rich的这项新的研究有助于解释相对于健康的脑细胞,寨卡病毒更偏好于胶质母细胞瘤干细胞。αvβ5整联素由两个独立的亚基--αv和β5--组成。Rich团队发现胶质母细胞瘤干细胞同时产生大量的αv亚基(与干细胞相关)和β5亚基(与癌细胞相关)。他们发现这些亚基一起形成的αvβ5整联素在胶质母细胞瘤干细胞存活中起着重要作用。这些高水平的αvβ5整联素也有助于解释为何在这项新的研究中,胶质母细胞瘤干细胞被寨卡病毒杀死的比例远高于正常大脑干细胞或其他脑细胞类型。
Rich说,“事实证明,使得癌细胞变成侵袭性癌症干细胞的αvβ5正是寨卡病毒用来感染我们细胞的分子。”
为了了解这在人类疾病模型中如何可能发挥作用,Rich团队与加州大学圣地亚哥分校医学院人脑疾病建模专家Alysson Muotri博士合作。论文共同第一作者、Muotri实验室博士后研究员Pinar Mesci构建出一种新的脑肿瘤模型,在这种模型中,将人胶质母细胞瘤肿瘤移植到人脑类器官中。这些研究人员发现寨卡病毒可以选择性地消除人脑类器官中的胶质母细胞瘤干细胞。抑制αvβ5整联素逆转了这种抗癌活性,这进一步突出了这种分子在寨卡病毒破坏细胞的能力中起着关键作用。
如今,Rich团队正在与其他的研究团队合作开展靶向药物研究。除了像Rana团队一样寻找阻断寨卡病毒的药物之外,Rich还对这种病毒进行基因修饰感兴趣,这种遗传修饰可以让它更好地靶向脑癌细胞,同时不影响健康细胞。
Rich说,“尽管我们可能需要对正常的寨卡病毒进行基因修饰以使得它更安全地治疗脑瘤,但是我们也可能能够利用这种病毒破坏细胞的机制来改善我们治疗胶质母细胞瘤的方式。我们应当关注病毒。它们已经过多年进化,非常擅长靶向和入侵体内的特定细胞。”(生物谷 Bioon.com)
参考资料:
1.Shaobo Wang et al. Integrin αvβ5 Internalizes Zika Virus during Neural Stem Cells Infection and Provides a Promising Target for Antiviral Therapy. Cell Reports, 2020, doi:10.1016/j.celrep.2019.11.020.
2.Zhe Zhu et al. Zika Virus Targets Glioblastoma Stem Cells through a SOX2-Integrin αvβ5 Axis. Cell Stem Cell, 2020, doi:10.1016/j.stem.2019.11.016.
3.Zhe Zhu et al. Zika virus has oncolytic activity against glioblastoma stem cells. Journal of Experimental Medicine, 2017, doi:10.1084/jem.20171093.
4.Zika Virus’ Key into Brain Cells ID’d, Leveraged to Block Infection and Kill Cancer Cells
https://ucsdnews.ucsd.edu/pressrelease/zika-virus-key-into-brain-cells-idd-leveraged-to-block-infection-and-kill-cancer-cells
寨卡病毒感染会阻碍新生儿的大脑发育,从而导致一种称为小头畸形的疾病。在这种疾病中,婴儿出生时头部异常小。为了确定如何最好地阻止和治疗这种病毒感染,科学家们首先需要了解这种病原体如何进入脑细胞。
在两项新的研究中,来自美国加州大学圣地亚哥分校医学院的两个研究团队独立地鉴定出相同的分子---αvβ5整合素---是寨卡病毒入侵大脑干细胞的关键。他们还发现了利用这种整合素来阻止寨卡病毒感染细胞并让它发挥有益作用的方法:减少脑癌干细胞。
整合素是嵌入细胞表面的分子。它们在细胞粘附和通信中起重要作用,并且已知参与癌症的进展和转移。几种其他的整合素是诸如腺病毒、口蹄疫病毒和轮状病毒之类的其他病毒的已知入侵点,但αvβ5先前在病毒感染中的作用尚不为人所知。
寻找关键分子
在第一项新的研究中,加州大学圣地亚哥分校医学院的Tariq Rana博士及其研究团队使用CRISPR基因编辑系统性地剔除了在实验室培养皿中进行三维培养的人胶质母细胞瘤干细胞(glioblastoma stem cell, GSC,一种脑癌干细胞)中的每个基因。随后,他们让每种GSC细胞突变体暴露于寨卡病毒,以便确定哪些基因及其编码的蛋白是这种病毒入侵GSC细胞所必需的。这种病毒首次用绿色荧光蛋白(GFP)加以标记,从而允许这些研究人员可视化观察这种病毒入侵这些细胞。相关研究结果于2020年1月16日在线发表在Cell Reports期刊上,论文标题为“Integrin αvβ5 Internalizes Zika Virus during Neural Stem Cells Infection and Provides a Promising Target for Antiviral Therapy”。

图片来自Cell Reports, 2020, doi:10.1016/j.celrep.2019.11.020。
Rana团队发现了92个特异性的人脑癌干细胞基因是寨卡病毒入侵这种细胞并在其中复制所需要的。但是,其中的一个基因尤其重要,它就是编码αvβ5整合素的基因。
Rana说,“众所周知,整合素是许多不同的病毒用来入侵人细胞的分子。我原本期待发现寨卡病毒使用多种整合素,或者使用也被其他病毒使用的其他细胞表面分子。但是,我们发现寨卡病毒使用了αvβ5,这是比较独特的。当我们进一步研究αvβ5在大脑中的表达时,这完全可以理解,这是因为αvβ5是唯一在神经干细胞中富集的整合素成员,而寨卡病毒偏好感染神经干细胞。因此,我们认为αvβ5是寨卡病毒能够感染脑细胞的关键因素。”
阻断寨卡病毒感染
在第二项新的研究中,鉴于了解很多病毒使用整合素入侵人细胞,加州大学圣地亚哥分校医学院的Jeremy Rich博士及其研究团队使用不同的抗体来抑制每种整合素,以便观察哪种抗体具有最好的抑制效果。相关研究结果于2020年1月16日在线发表在Cell Stem Cell期刊上,论文标题为“Zika Virus Targets Glioblastoma Stem Cells through a SOX2-Integrin αvβ5 Axis”。
Rich说,“当我们阻断其他整合素时,效果上并没有区别。但是用抗体阻断αvβ5几乎可以完全阻断这种病毒感染脑癌干细胞和正常大脑干细胞的能力。”
Rich团队随后在胶质母细胞瘤小鼠模型中利用抗体抑制αvβ5,或者让编码它的基因失活。这两种方法都可阻止寨卡病毒感染,并且允许这些经过治疗的小鼠比未治疗的小鼠活得更长。他们还发现阻断在外科手术期间从患者身上取出的胶质母细胞瘤肿瘤样本中的αvβ5可阻断寨卡病毒感染。
此外,Rich团队每天用靶向αvβ5整合素的实验性抗癌药物西仑吉肽(cilengitide)或SB273005治疗小鼠,从而阻断它们体内的αvβ5。在寨卡病毒感染六天后,这些经过治疗的小鼠的大脑中的寨卡病毒数量是空白对照小鼠(mock-treated mice)中的一半。
Rana说,“有趣的是,这些发现不仅有助于推进寨卡病毒研究,而且还为我们利用抗体或小分子抑制剂类似地阻断使用其他整合素的多种病毒入侵提供了可能性。”
Rich团队如今正在培育一种大脑中缺乏αvβ5整合素的小鼠模型,这种模型将允许他们确定性地证实这种分子是寨卡病毒入侵和复制所必需的。
利用寨卡病毒治疗脑癌
Rich是一名神经肿瘤学家,擅长诊断和治疗胶质母细胞瘤患者,其中胶质母细胞瘤是一种极具侵袭性的致命性脑瘤。当他首次观察到寨卡病毒如何导致大脑组织萎缩时,他就想到了自己在治疗胶质母细胞瘤患者时所希望达到的效果。在2017年,他和合作者在一项研究中确定了寨卡病毒选择性地靶向并杀死胶质母细胞瘤干细胞(Journal of Experimental Medicine, 2017, doi:10.1084/jem.20171093)。鉴于这种脑癌干细胞容易对标准治疗产生抵抗力,这也是胶质母细胞瘤术后复发并导致患者存活率更低的重要原因。
Rich的这项新的研究有助于解释相对于健康的脑细胞,寨卡病毒更偏好于胶质母细胞瘤干细胞。αvβ5整联素由两个独立的亚基--αv和β5--组成。Rich团队发现胶质母细胞瘤干细胞同时产生大量的αv亚基(与干细胞相关)和β5亚基(与癌细胞相关)。他们发现这些亚基一起形成的αvβ5整联素在胶质母细胞瘤干细胞存活中起着重要作用。这些高水平的αvβ5整联素也有助于解释为何在这项新的研究中,胶质母细胞瘤干细胞被寨卡病毒杀死的比例远高于正常大脑干细胞或其他脑细胞类型。
Rich说,“事实证明,使得癌细胞变成侵袭性癌症干细胞的αvβ5正是寨卡病毒用来感染我们细胞的分子。”
为了了解这在人类疾病模型中如何可能发挥作用,Rich团队与加州大学圣地亚哥分校医学院人脑疾病建模专家Alysson Muotri博士合作。论文共同第一作者、Muotri实验室博士后研究员Pinar Mesci构建出一种新的脑肿瘤模型,在这种模型中,将人胶质母细胞瘤肿瘤移植到人脑类器官中。这些研究人员发现寨卡病毒可以选择性地消除人脑类器官中的胶质母细胞瘤干细胞。抑制αvβ5整联素逆转了这种抗癌活性,这进一步突出了这种分子在寨卡病毒破坏细胞的能力中起着关键作用。
如今,Rich团队正在与其他的研究团队合作开展靶向药物研究。除了像Rana团队一样寻找阻断寨卡病毒的药物之外,Rich还对这种病毒进行基因修饰感兴趣,这种遗传修饰可以让它更好地靶向脑癌细胞,同时不影响健康细胞。
Rich说,“尽管我们可能需要对正常的寨卡病毒进行基因修饰以使得它更安全地治疗脑瘤,但是我们也可能能够利用这种病毒破坏细胞的机制来改善我们治疗胶质母细胞瘤的方式。我们应当关注病毒。它们已经过多年进化,非常擅长靶向和入侵体内的特定细胞。”(生物谷 Bioon.com)
参考资料:
1.Shaobo Wang et al. Integrin αvβ5 Internalizes Zika Virus during Neural Stem Cells Infection and Provides a Promising Target for Antiviral Therapy. Cell Reports, 2020, doi:10.1016/j.celrep.2019.11.020.
2.Zhe Zhu et al. Zika Virus Targets Glioblastoma Stem Cells through a SOX2-Integrin αvβ5 Axis. Cell Stem Cell, 2020, doi:10.1016/j.stem.2019.11.016.
3.Zhe Zhu et al. Zika virus has oncolytic activity against glioblastoma stem cells. Journal of Experimental Medicine, 2017, doi:10.1084/jem.20171093.
4.Zika Virus’ Key into Brain Cells ID’d, Leveraged to Block Infection and Kill Cancer Cells
https://ucsdnews.ucsd.edu/pressrelease/zika-virus-key-into-brain-cells-idd-leveraged-to-block-infection-and-kill-cancer-cells
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


