超分辨光镜-电镜关联成像研究取得进展
来源:生物物理所 2019-10-17 13:05
10月14日,中国科学院生物物理研究所徐涛课题组与徐平勇课题组合作,在Nature Methods上发表了题为mEosEM withstands osmium staining and Epon embedding for super-resolution CLEM 的研究论文。他们发展了第一个常规电镜制样后保持荧光的光转化荧光蛋白,首次实现了Epon后固定的同层超薄样品的
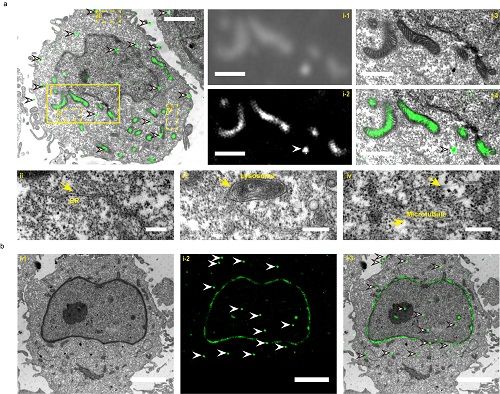
10月14日,中国科学院生物物理研究所徐涛课题组与徐平勇课题组合作,在Nature Methods上发表了题为mEosEM withstands osmium staining and Epon embedding for super-resolution CLEM 的研究论文。他们发展了第一个常规电镜制样后保持荧光的光转化荧光蛋白,首次实现了Epon后固定的同层超薄样品的超分辨光镜-电镜关联成像,极大地促进了超分辨光镜和电镜成像领域的发展,有望在生物学中广泛应用。
蛋白质等分子在细胞中的特定位置组装成蛋白质机器进而发挥生物学功能,因此研究蛋白质等分子在细胞中的精确定位对于揭示蛋白质机器的组装和分子机制至关重要。电子显微镜具有亚纳米尺度的空间分辨率,是生命科学领域中不可缺少的研究工具,然而在电镜图像中定位目标蛋白具有很大的挑战。例如常用的免疫电镜利用抗原—抗体反应在电镜图像中标记和定位蛋白质,该方法标记效率低,而且对抗体的特异性依赖性很大。近年来出现的光镜-电镜关联成像技术是一种双模态成像技术,该技术利用光镜成像来定位目标分子,标记效率和特异性高,同时还可利用电镜对细胞进行超微结构成像。超分辨光镜-电镜关联是更先进的光电关联技术,其中超分辨光镜打破了光学衍射极限,将成像的空间分辨率提高到几十纳米。
光电关联技术的核心难点是电镜制样后荧光分子无法保持荧光。当前光电关联成像一般是先用光镜对整个细胞成像,然后再固定和包埋电镜制样,导致电镜成像中不容易找到光镜图像中的同一细胞,而且整体细胞的光镜图像与超薄切片的电镜图像关联不准。常规电镜制样方法,包括使用1% 锇酸固定来保持细胞的超微结构和电镜衬度,以及使用Epon包埋来保证样品的切片质量,能够获得高质量的电镜图片,并可应用于大尺度生物样品如脑组织的连续切片和3D重构。因此,急需发展抗锇酸固定和Epon包埋的荧光蛋白,在电镜制样的超薄切片中保持荧光,实现真正的光电关联。
该研究中,团队成员发展了第一个抗锇酸固定和Epon包埋的荧光蛋白,该荧光蛋白在电镜制样后仍然保持荧光并具有光开关的活性,通过优化超薄切片中单分子定位算法和成像方法,首次实现了Epon后固定电镜样品的同层超分辨光镜-电镜关联成像。该光电关联成像方法很好地保留了电镜图像中线粒体等亚细胞结构,并具有单分子定位超分辨光镜成像的单分子定位精度。利用该技术合作团队成功实现了线粒体和核膜的光电关联成像(如图)。该荧光蛋白将在神经以及脑科学等需要对大尺度厚样品进行连续切片和3D重构的光电关联中得到广泛应用。
中科院院士徐涛领衔的仪器研发团队近年来致力于显微成像仪器设备和技术方法的研究和开发,先后研制出偏振单分子干涉成像、冷冻单分子定位成像以及超分辨光电融合成像系统,开发了多种新的超分辨显微成像方法。徐平勇课题组主要致力于发展多种用于超分辨成像如PALM/STORM、SOFI、SIM等的探针,并基于探针的光化学特性发展新的成像方法如贝叶斯单分子超分辨成像方法SIMBA等,来提高超分辨成像的时空分辨率。该工作是徐涛课题组/徐平勇课题组合作,继PALM成像探针mEos3.2(Nature Methods,2012)、活细胞超分辨成像方法Quick-SIMBA(Nano Letter,2019)后在超分辨成像领域取得的又一重要研究成果。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


