我国科学家实现单细胞表观组学新突破:两种革新单细胞ChIP-seq技术解码细胞命运决定机制
来源:科技部 2019-10-03 22:52
在国家重点研发计划“干细胞及转化”重点专项(批准号:2017YFA0103402)等资助下,北京大学分子医学研究所、北大-清华生命科学联合中心何爱彬课题组近期突破单细胞表观遗传研究的瓶颈,开发了两种具有普适性、操作简单、风格迥异的单细胞ChIP-seq技术,可适应于不同课题研究需要,解析发育与疾病状态下细胞命运决定调控机制。这两项技术分别于2019年8月27日在Molecular Cell和201
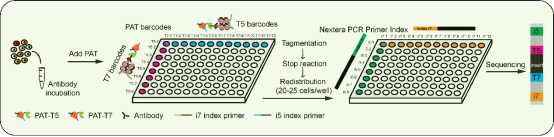
在国家重点研发计划“干细胞及转化”重点专项(批准号:2017YFA0103402)等资助下,北京大学分子医学研究所、北大-清华生命科学联合中心何爱彬课题组近期突破单细胞表观遗传研究的瓶颈,开发了两种具有普适性、操作简单、风格迥异的单细胞ChIP-seq技术,可适应于不同课题研究需要,解析发育与疾病状态下细胞命运决定调控机制。这两项技术分别于2019年8月27日在Molecular Cell和2019年9月3日在Nature Cell Biology在线发表。研究论文题目分别为“CoBATCH for high-throughput single-cell epigenomic profiling”和“Profiling chromatin state by single-cell itChIP-seq”。
多细胞生物体由具有相同基因组的不同细胞类型组成,在器官组织发育过程中,细胞状态和细胞命运决定的机制一直是领域普遍关心的问题。无论在发育过程还是疾病状态下,表观遗传因素(不改变DNA序列的情况下却能引起基因表达变化或表型)在细胞命运决定中起着指导性作用。细胞类型和功能异质性往往通过调控基因表达来实现。目前研究多集中在单细胞转录组水平,单细胞水平解析表观调控机制也鲜有报道,而从单细胞、全基因组范围研究组蛋白修饰和转录因子如何控制细胞谱系发生、命运决定则尚属空缺。
技术的革新为解析细胞命运决定的机制带来了新的可能性。染色质免疫共沉淀(ChIP-seq)是研究表观遗传调控的重要技术手段,可以在全基因组范围内捕获DNA-蛋白质的相互作用。但受限于实验原理和仪器设备,ChIP-seq技术在单细胞水平的研究和应用一直进展缓慢,目前还缺乏一种具有普适性、易操作、高质量的单细胞ChIP-seq技术。为解决这一技术难题,该研究组采用不同的实验策略,开发出两种新型单细胞ChIP-seq技术,并将其命名为CoBATCH和sc-itChIP。前者利用融合蛋白PAT(Protein A-Tn5)识别和切割抗体结合的特定基因组区域,并结合组合条形码标记单细胞技术,实现了高通量的单细胞捕获;后者利用Tn5均匀切割基因组,随后用免疫共沉淀富集目的基因组片段。研究者用CoBATCH单细胞技术首次解析了小鼠胚胎10个不同器官(心脏、肝脏、肺、左脑、右脑、后脑、肾脏、皮肤、肌肉和小肠)的内皮细胞谱系发育、分化和功能的异质性。通过整合单细胞itChIP和单细胞转录组数据,研究者揭示了心脏干细胞向心肌和内皮细胞分化过程中细胞类型特异性增强子对细胞命运决定的调控机制。
新技术引领生命科学的发展,该课题组不仅开发了适合高通量样品的单细胞ChIP-seq技术——CoBATCH,也开发出单细胞itChIP技术用于捕获起始量只有几十个单细胞的样品,这为研究稀少细胞样品例如植入前胚胎等的表观调控异质性提供了新的技术方法。这两种单细胞ChIP-seq将为解决细胞命运决定等最本质的发育生物学问题以及解析复杂的疾病发生过程提供强有力的技术手段。
北京大学何爱彬研究员为这两篇文章的通讯作者。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


