Science子刊:重大进展!RIG-I激活对免疫检查点阻断发挥抗肿瘤疗效至关重要
来源:本站原创 2019-09-21 07:57
2019年9月21日讯/生物谷BIOON/---靶向诸如CTLA-4或PD-1之类的免疫检查点已被证实是一种有效的肿瘤疗法。双重抑制CTLA-4途径和PD-1途径在包括黑色素瘤、肾癌和非小细胞肺癌在内的不同恶性肿瘤中显示出特别强的临床反应。然而,在不同患者之间表现的临床反应存在显著的差异,而且人们对潜在机制的理解仍然有限。几种因素已被提出用来预测对免疫检查点阻断(immune checkpoint
2019年9月21日讯/生物谷BIOON/---靶向诸如CTLA-4或PD-1之类的免疫检查点已被证实是一种有效的肿瘤疗法。双重抑制CTLA-4途径和PD-1途径在包括黑色素瘤、肾癌和非小细胞肺癌在内的不同恶性肿瘤中显示出特别强的临床反应。然而,在不同患者之间表现的临床反应存在显著的差异,而且人们对潜在机制的理解仍然有限。
几种因素已被提出用来预测对免疫检查点阻断(immune checkpoint blockade, ICB)的治疗反应,包括肿瘤突变负荷、主要组织相容性复合物(MHC)分子的表达和多样性、T细胞浸润的肿瘤微环境、肠道菌群的组成以及缺乏肿瘤免疫抑制途径。通常而言,免疫检查点阻断被认为(重新)激活肿瘤抗原特异性T细胞。I型干扰素(IFN-I)是产生这种抗肿瘤T细胞反应的一种重要因素,这是因为它促进CD8α+树突细胞在肿瘤内积累和抗原特异性细胞毒性T细胞的交叉激活来对抗生长中的肿瘤,最终导致肿瘤消退。因此,IFN-I系统在肿瘤周围的激活与肿瘤内CTL积累和原发性小鼠黑色素瘤自发消退的迹象相关。大量肿瘤样本中的IFN-I基因特征与黑色素瘤患者对免疫检查点阻断作出有利的临床反应相关。
针对肿瘤微环境中的IFN-1诱导途径,近期的研究已揭示细胞质核酸感应受体系统在其中作出了重要贡献。尽管这些先天免疫受体经常在肿瘤细胞中表达,但是它们在抗肿瘤免疫反应产生中的作用主要在宿主骨髓细胞中实现。特别地,树突细胞中的cGAS/STING途径与免疫检查点阻断期间的肿瘤排斥和放疗诱导的肿瘤免疫监测相关。cGAS/STING是一种细胞质模式识别受体系统,可识别并指示在各种条件(包括细胞凋亡、坏死和DNA病原体复制)下产生的异常细胞质双链DNA(dsDNA)的存在。在树突细胞中,STING可以被来自垂死的癌细胞的DNA激活(这一点可通过放疗或化疗期间的基因毒性应激得以加强),从而诱导高水平的IFN-1,而这能够促进T细胞的最佳交叉激活和有效的抗肿瘤免疫反应。
作为另一种重要的细胞质核酸传感蛋白,RNA受体RIG-I(由基因DDX58编码)也与抗肿瘤免疫反应有关。RIG-I主要在病毒或细菌感染期间检测双链5'-三磷酸RNA(3pRNA)。一旦与骨髓细胞中的配体结合,RIG-I就会招募称为线粒体抗病毒信号蛋白(MAVS)的衔接蛋白来诱导促炎性细胞因子和IFN-I产生,以及ASC依赖性的炎性体激活,从而导致多样性的先天性和适应性免疫反应。
骨髓细胞中的RIG-I途径激活可诱导IFN-1依赖性的自然杀伤细胞活化和源自原发性黑色素瘤的转移瘤消退。cGAS/STING和RIG-I信号途径都可以触发各种形式的程序性细胞死亡。然而,不同于参与IFN-1释放的其他细胞溶质核酸受体(即cGAS/STING)的是,肿瘤细胞内的RIG-I靶向激活已被证实可诱导程序性癌细胞死亡的免疫原性变体形式(immunogenic variant of programmed cancer cell death, ICD),从而抑制一系列事先建立的肿瘤实体的生长。然而,驱动RIG-I诱导的ICD的分子机制仍未完全确定,但是这似乎涉及促凋亡的仅含BH3区域蛋白(BH3–only protein)以及caspase-3的激活。
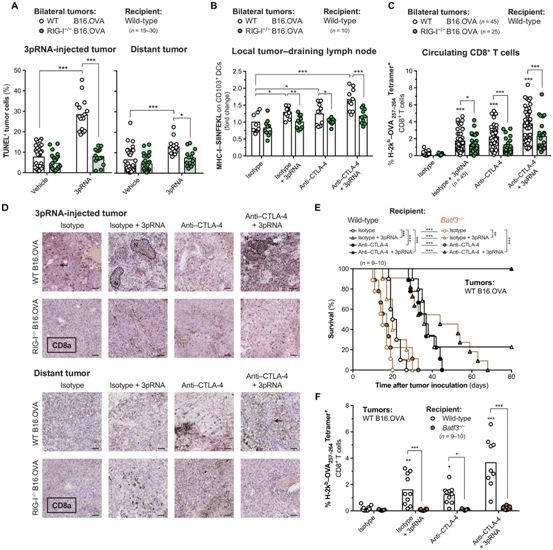
肿瘤内在的核酸受体信号在多大程度上影响ICB介导的抗肿瘤免疫反应尚不清楚。鉴于RIG-I/MAVS途径是IFN-1产生和程序性癌细胞死亡的重要调节因子,来自德国慕尼黑工业大学的研究人员猜测它可能参与影响ICB的治疗结果,并且可能适用于联合模式免疫治疗方法。 在一项新的研究中,这些研究人员证实抗CTLA-4免疫疗法及其与抗PD-1免疫疗法的联合使用都依赖于肿瘤细胞内在的细胞质RNA受体RIG-I激活。从机制上而言,肿瘤细胞内在的RIG-I信号诱导caspase-3介导的肿瘤细胞死亡,CD103+树突细胞交叉呈递肿瘤相关抗原,随后的肿瘤抗原特异性CD8+ T细胞增殖及其这些T细胞在肿瘤组织内部的积累。相关研究结果发表在2019年9月13日的Science Immunology期刊上,论文标题为“RIG-I activation is critical for responsiveness to checkpoint blockade”。
在肿瘤和非恶性宿主细胞中利用5'-三磷酸化RNA对RIG-I进行治疗性靶向可强效地增强CTLA-4免疫检查点阻断在几种临床前癌症模型中的疗效。在人体中,对原发性黑色素瘤样本的转录组分析揭示出DDX58(编码RIG-I的基因)的高表达、T细胞受体和抗原呈递途径活性与延长的总体存活期之间存在较强的关联性。
再者,在接受抗CTLA-4免疫检查点阻断治疗的黑色素瘤患者中,较高的DDX58 RIG-I转录活性与持久的临床反应显著相关。
此外,通过基因手段设计出缺乏参与DNA和RNA检测、细胞死亡和IFN-1信号途径的关键分子的黑色素瘤细胞系,这些研究人员对这些途径在调节抗肿瘤免疫反应和对免疫检查点阻断的反应性中的相对重要性进行了分类。
由此可见,这些数据确定了肿瘤及其微环境中的RIG-I信号激活是免疫检查点抑制剂介导的癌症免疫疗法的一个关键组分。它们还表明激活对细胞质RNA的感知(或者说检测)能力可能可用于增加免疫原性较差的肿瘤的免疫原性。(生物谷 Bioon.com)
参考资料:
Simon Heidegger et al. RIG-I activation is critical for responsiveness to checkpoint blockade. Science Immunology, 2019, doi:10.1126/sciimmunol.aau8943.
几种因素已被提出用来预测对免疫检查点阻断(immune checkpoint blockade, ICB)的治疗反应,包括肿瘤突变负荷、主要组织相容性复合物(MHC)分子的表达和多样性、T细胞浸润的肿瘤微环境、肠道菌群的组成以及缺乏肿瘤免疫抑制途径。通常而言,免疫检查点阻断被认为(重新)激活肿瘤抗原特异性T细胞。I型干扰素(IFN-I)是产生这种抗肿瘤T细胞反应的一种重要因素,这是因为它促进CD8α+树突细胞在肿瘤内积累和抗原特异性细胞毒性T细胞的交叉激活来对抗生长中的肿瘤,最终导致肿瘤消退。因此,IFN-I系统在肿瘤周围的激活与肿瘤内CTL积累和原发性小鼠黑色素瘤自发消退的迹象相关。大量肿瘤样本中的IFN-I基因特征与黑色素瘤患者对免疫检查点阻断作出有利的临床反应相关。
针对肿瘤微环境中的IFN-1诱导途径,近期的研究已揭示细胞质核酸感应受体系统在其中作出了重要贡献。尽管这些先天免疫受体经常在肿瘤细胞中表达,但是它们在抗肿瘤免疫反应产生中的作用主要在宿主骨髓细胞中实现。特别地,树突细胞中的cGAS/STING途径与免疫检查点阻断期间的肿瘤排斥和放疗诱导的肿瘤免疫监测相关。cGAS/STING是一种细胞质模式识别受体系统,可识别并指示在各种条件(包括细胞凋亡、坏死和DNA病原体复制)下产生的异常细胞质双链DNA(dsDNA)的存在。在树突细胞中,STING可以被来自垂死的癌细胞的DNA激活(这一点可通过放疗或化疗期间的基因毒性应激得以加强),从而诱导高水平的IFN-1,而这能够促进T细胞的最佳交叉激活和有效的抗肿瘤免疫反应。
作为另一种重要的细胞质核酸传感蛋白,RNA受体RIG-I(由基因DDX58编码)也与抗肿瘤免疫反应有关。RIG-I主要在病毒或细菌感染期间检测双链5'-三磷酸RNA(3pRNA)。一旦与骨髓细胞中的配体结合,RIG-I就会招募称为线粒体抗病毒信号蛋白(MAVS)的衔接蛋白来诱导促炎性细胞因子和IFN-I产生,以及ASC依赖性的炎性体激活,从而导致多样性的先天性和适应性免疫反应。
骨髓细胞中的RIG-I途径激活可诱导IFN-1依赖性的自然杀伤细胞活化和源自原发性黑色素瘤的转移瘤消退。cGAS/STING和RIG-I信号途径都可以触发各种形式的程序性细胞死亡。然而,不同于参与IFN-1释放的其他细胞溶质核酸受体(即cGAS/STING)的是,肿瘤细胞内的RIG-I靶向激活已被证实可诱导程序性癌细胞死亡的免疫原性变体形式(immunogenic variant of programmed cancer cell death, ICD),从而抑制一系列事先建立的肿瘤实体的生长。然而,驱动RIG-I诱导的ICD的分子机制仍未完全确定,但是这似乎涉及促凋亡的仅含BH3区域蛋白(BH3–only protein)以及caspase-3的激活。

图片来自Science Immunology, 2019, doi:10.1126/sciimmunol.aau8943。
肿瘤内在的核酸受体信号在多大程度上影响ICB介导的抗肿瘤免疫反应尚不清楚。鉴于RIG-I/MAVS途径是IFN-1产生和程序性癌细胞死亡的重要调节因子,来自德国慕尼黑工业大学的研究人员猜测它可能参与影响ICB的治疗结果,并且可能适用于联合模式免疫治疗方法。 在一项新的研究中,这些研究人员证实抗CTLA-4免疫疗法及其与抗PD-1免疫疗法的联合使用都依赖于肿瘤细胞内在的细胞质RNA受体RIG-I激活。从机制上而言,肿瘤细胞内在的RIG-I信号诱导caspase-3介导的肿瘤细胞死亡,CD103+树突细胞交叉呈递肿瘤相关抗原,随后的肿瘤抗原特异性CD8+ T细胞增殖及其这些T细胞在肿瘤组织内部的积累。相关研究结果发表在2019年9月13日的Science Immunology期刊上,论文标题为“RIG-I activation is critical for responsiveness to checkpoint blockade”。
在肿瘤和非恶性宿主细胞中利用5'-三磷酸化RNA对RIG-I进行治疗性靶向可强效地增强CTLA-4免疫检查点阻断在几种临床前癌症模型中的疗效。在人体中,对原发性黑色素瘤样本的转录组分析揭示出DDX58(编码RIG-I的基因)的高表达、T细胞受体和抗原呈递途径活性与延长的总体存活期之间存在较强的关联性。
再者,在接受抗CTLA-4免疫检查点阻断治疗的黑色素瘤患者中,较高的DDX58 RIG-I转录活性与持久的临床反应显著相关。
此外,通过基因手段设计出缺乏参与DNA和RNA检测、细胞死亡和IFN-1信号途径的关键分子的黑色素瘤细胞系,这些研究人员对这些途径在调节抗肿瘤免疫反应和对免疫检查点阻断的反应性中的相对重要性进行了分类。
由此可见,这些数据确定了肿瘤及其微环境中的RIG-I信号激活是免疫检查点抑制剂介导的癌症免疫疗法的一个关键组分。它们还表明激活对细胞质RNA的感知(或者说检测)能力可能可用于增加免疫原性较差的肿瘤的免疫原性。(生物谷 Bioon.com)
参考资料:
Simon Heidegger et al. RIG-I activation is critical for responsiveness to checkpoint blockade. Science Immunology, 2019, doi:10.1126/sciimmunol.aau8943.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


