研究发现DR3信号通路通过调控ILC3从而调节肠道炎症的新机制
来源:上海营养与健康研究所 2019-08-03 16:02
近期,国际学术期刊《自然-通讯》(Nature Communications)在线发表了中国科学院上海营养与健康研究所邱菊研究组的研究成果Activation of DR3 signaling causes loss of ILC3s and exacerbates intestinal inflammation。该研究报道了DR3信号通路通过调控肠道3型天然淋巴细胞(group 3 innate
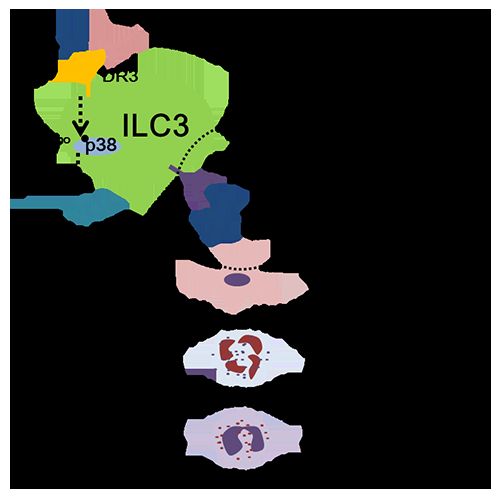
近期,国际学术期刊《自然-通讯》(Nature Communications)在线发表了中国科学院上海营养与健康研究所邱菊研究组的研究成果Activation of DR3 signaling causes loss of ILC3s and exacerbates intestinal inflammation。该研究报道了DR3信号通路通过调控肠道3型天然淋巴细胞(group 3 innate lymphoid cell,ILC3)从而调节肠道炎症的新机制。
死亡受体3(DR3)和它的配体TL1A被报道在炎症性肠病(IBD)中起到重要的调节作用。过去的研究表明,DR3/TL1A信号通路能够通过促进Th1和Th17的免疫应答从而在炎症性肠病中发挥致病作用。同时还有研究表明DR3/TL1A信号通路能够维持肠道Treg细胞的稳态水平,从而发挥免疫抑制的作用,缓解肠炎的发生。ILC3是固有免疫系统的重要组成部分,对于肠道免疫具有重要的调节作用,且ILC3表达高水平的DR3。然而,TL1A/DR3信号通路对ILC3s的调控机制目前仍不明确。另外,TL1A/DR3信号通路是否通过调节ILC3影响肠道炎症也没有被报道。
该项研究利用DR3激动性抗体(α-DR3)在体内激活TL1A/DR3信号,从而研究TL1A/DR3信号对ILC3的调控作用。研究发现激活DR3信号会造成大肠ILC3细胞数目的减少。利用中和性抗体中和体内的GM-CSF和IL-23都能够显着地逆转α-DR3引起的大肠ILC3减少。机制研究发现,α-DR3通过活化ILC3的p38信号通路从而促进其GM-CSF的分泌。GM-CSF分泌的增加能够进一步导致招募致炎性髓系细胞(嗜酸性粒细胞、巨噬细胞以及中性粒细胞)到肠道,髓系来源细胞的浸润最终造成IL-23表达的增加和肠道炎症的加重,IL-23则最终造成大肠ILC3细胞的减少。该研究利用可溶性DR3蛋白中和体内的TL1A能够有效地缓解α-CD40以及DSS诱导的肠炎。另外,α-DR3的体内处理能够加重DSS诱导的肠炎,并且α-DR3对肠炎的加重作用并不依赖于适应性免疫系统。更为重要的是,在ILC3缺失的情况下,α-DR3不能够加重DSS诱导的肠炎,这表明α-DR3加重肠炎的作用依赖于ILC3。
综上所述,TL1A/DR3可以通过激活ILC3在肠道中发挥致炎作用。α-DR3可以同时“驱逐”肠道中的ILC3,该过程依赖于GM-CSF以及髓系细胞来源的IL-23。由于ILC3在多种固有免疫肠炎中有致病作用,这种“驱逐”作用可能对持续不断加重的肠炎和损伤有负反馈调节的意义。过去的临床研究发现克罗恩氏病人的IL-22+ ILC3的百分比减少,该工作发现的GM-CSF/IL-23通路“驱逐”肠道中的ILC3也可能是IBD病人中IL-22+ ILC3细胞减少的机制之一。该研究对IBD的诊断、治疗提供了潜在的靶点。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


