研究揭示细菌III型分泌系统调控机制
来源:微生物所 2019-05-01 14:15
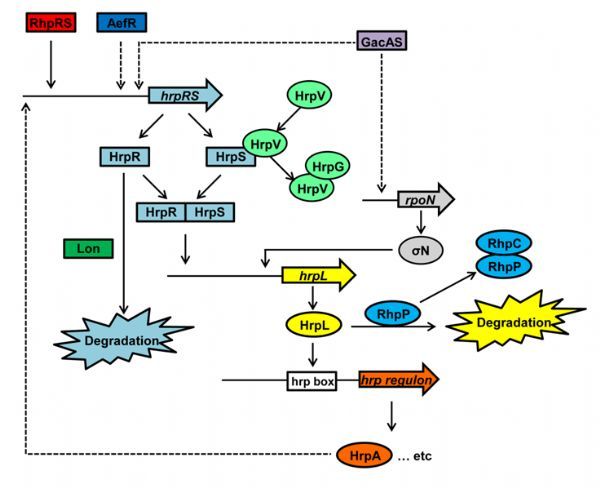
III型分泌系统是大多数革兰氏阴性病原细菌(包括植物病原菌和动物病原菌)感染宿主的重要“武器”,是由蛋白复合体构成的跨膜分子装置。病原菌通过III型分泌系统将一系列效应蛋白注入宿主细胞内,从而逃避宿主细胞的免疫防御并建立感染。III型分泌系统基因的表达受各种环境因素和宿主因素的影响,在丰富培养基中其表达受到抑制,而在植物细胞间隙或基本培养基中能够诱导其表达。尽管目前已经鉴定了一些调节III型分泌系
III型分泌系统是大多数革兰氏阴性病原细菌(包括植物病原菌和动物病原菌)感染宿主的重要“武器”,是由蛋白复合体构成的跨膜分子装置。病原菌通过III型分泌系统将一系列效应蛋白注入宿主细胞内,从而逃避宿主细胞的免疫防御并建立感染。III型分泌系统基因的表达受各种环境因素和宿主因素的影响,在丰富培养基中其表达受到抑制,而在植物细胞间隙或基本培养基中能够诱导其表达。尽管目前已经鉴定了一些调节III型分泌系统信号转导的组分,如,双组分系统GacAS,ATP依赖的蛋白酶Lon,NtrC家族的转录因子HrpR和HrpS等,但细菌如何感应环境信号并作出相应反应的机制还知之甚少。
Pseudomonas savastanoi pv. phaseolicola(Psph)能够引起菜豆晕疫病,中国科学院微生物研究所贾燕涛课题组与中科院院士方荣祥、华南师范大学教授唐晓艳合作,揭示了Psph的rhpPC基因座中的双顺反子基因协同调节III型分泌系统基因表达的分子机制。rhpP编码一种金属蛋白酶,可以降解转录因子HrpL,HrpL是假单胞菌属细菌中ECF (extracytoplasmic function) 家族σ因子中的一员,能够识别III型基因启动子区hrp-box序列,从而激活下游hrp基因的表达。rhpC编码一个分子伴侣蛋白,能够抑制RhpP蛋白酶活性,同时,RhpC通过与RhpP互作,将RhpP从胞质转运到周质空间,减弱其在胞质中对HrpL的降解作用。rhpP和rhpC在丰富培养基和基本培养基中的表达模式不同,在营养丰富时,rhpP转录水平较高,rhpC转录水平较低;而在营养缺乏时,rhpP转录水平较低,rhpC转录水平较高,致使RhpP蛋白酶对HrpL的降解作用得到有效调节。该研究揭示了RhpP作为金属蛋白酶在不同环境条件下,通过分子伴侣RhpC精细调控细菌III型分泌系统的新机制。
该研究成果于4月18日在PLOS Pathogens 杂志上在线发表,题为Two components of the rhpPC operon coordinately regulate the type III secretion system and bacterial fitness in Pseudomonas savastanoi pv. phaseolicola。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->